Understanding Experimental Facts for the Transformation of Perezone into α- and β-pipitzols
DOI:
https://doi.org/10.29356/jmcs.v68i1.1926Keywords:
Perezone, α-pipitzol, β-pipitzol, reaction mechanism, concerted reactionAbstract
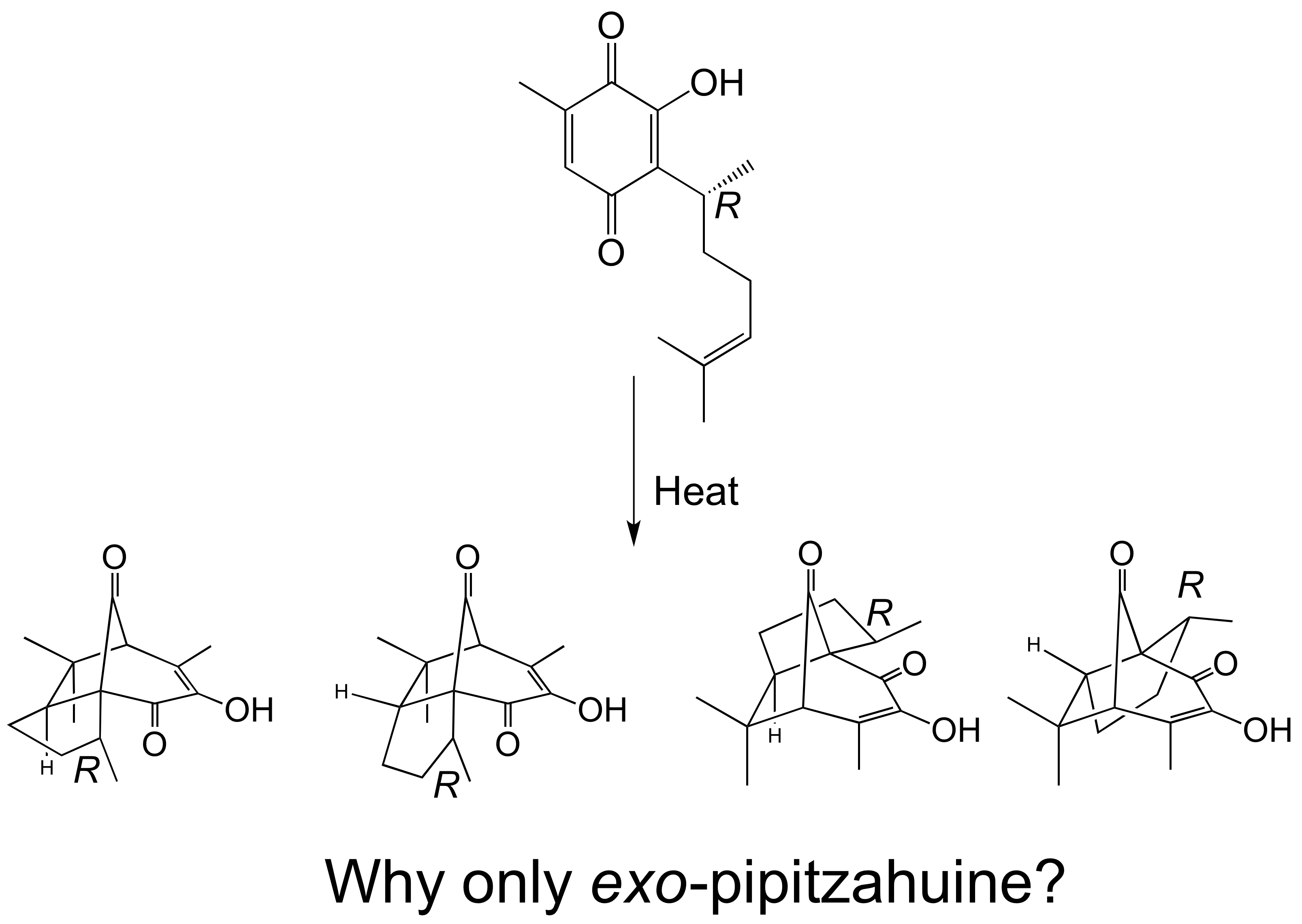
Under thermal conditions perezone, a sesquiterpene quinone, forms an equimolar amount of a- and β-pipitzol through an intermolecular cycloaddition reaction. Computational calculations at M06-2x/6-311++G(2d,2p) level of theory of the transition states and the associated reaction paths allow justifying the experimental observations. Only exo adducts are observed experimentally, which is in line with the calculated energy difference of 6.5 kcal/mol between the transition states associated with the endo and exo adducts. Activation free energy was accurately predicted, those the uncatalyzed thermal process of cycloaddition requires 37.0 kcal/mol. The study of the potential energy surface allows to establish the existence of folded conformers of perezone in the potential energy surface.
Resumen. En condiciones térmicas la perezona, una quinona sesquiterpénica, forma, cantidades equimolares de a- y β-pipitzoles a través de una reacción de cicloadición intramolecular. A nivel M06-2x/6-311++G(2d,2p) el cálculo de los estados de transición y de las trayectorias de reacción asociadas permiten justificar los resultados observados. Desde el punto de vista experimental sólo se forman los aductos exo y no los endo pues los estados de transición relacionados muestran una diferencia energética de 6.5 kcal/mol. La energía de activación calculada para el procedo desprovisto de catálisis es de 37.0 kcal/mol. El estudio de la superficie de energía potencial permite establecer la existencia de confórmeros plegados de la perezona.
Downloads
References
Walls, F.; Padilla, J.; Joseph-Nathan, P.; Giral, F.; Romo, J. Tel. Lett. 1965, 1577-1582. DOI: https://doi.org/10.1016/S0040-4039(01)84094-6.
Walls, F.; Padilla, J.; Joseph-Nathan, P.; Giral, F.; Escobar, M.: Romo, J. Tetrahedron. 1966, 22, 2387-2399. DOI: https://doi.org/10.1016/S0040-4020(01)82159-1.
Evans, S.V.; Yee, V.C.; García-Garibay, M.A.; Trotter, J. Acta Cryst. 1994, C50, 278-281. DOI: https://doi.org/10.1107/S0108270193009060.
Ylijoki, K.E.O.; Stryker, J.M. Chem Rev. 2013, 113, 2244-2266. DOI: https://doi.org/10.1021/cr300087g.
Weld, M.C. Ann. Ueber die Pipitzahoïnsäure, eineneigenthümlichen Pflanzenstoff, 1855, 95, 188-192. DOI: https://doi.org/10.1002/jlac.18550950205.
Ortiz-Reynoso, M.; Cuevas González-Bravo G. E. History of Pharmacy and Pharmaceuticals. 2022, 64, 154-186. DOI: https://doi.org/10.3368/hopp.64.2.154.
Rio de la Loza, L.; Discurso pronunciado por el catedrático de Química Médica de la Escuela de Medicina el Noviembre 23, 1852. Periódico de la Escuela de Medicina. 1853,1,131-137.
a) Pérez, S. Remitido. La Unión Médica. 1857, 2, 44-46. b) Jonás, A. La Farmacia. En la Exposición Internacional de Filadelfia. Semanario Farmacéutico. 1877, 6, 5764.
Pérez, S. La Farmacia.1890, 1. No. 7. 101-107.
Remfry, F.G.P. CXVI-Perezone. J. Chem. Soc. 1913, 103, 1076-1088. https://doi.org/10.1039/CT9130301076.
Kögl, F.; Boer, A. G. Rec. Trav. Chim. 1935, 54, 779-794. DOI:10.1002/recl.19350541005 DOI: https://doi.org/10.1002/recl.19350541005
Walls, F.; Salmón, M.; Padilla, J.; Joseph-Nathan, P.; Romo, J. Bol. Inst. Quím. Univ. Nac. Auton. Mex. 1965, 17, 3-15.
Archer, D.A.; Thomson, R.H. J. Chem. Soc. Chem. Commun. 1965, 354-355. DOI: https://doi.org/10.1039/C19650000354.
Bates, R.B.; Paknikar, S.K.; Thalacker, V.P. Chem & Ind. 1965, 1793.
Wagner, E.R.; Moss, R.D.; Brooker, R.M. Tet. Lett. 1965, 47, 4233-4239. DOI: https://doi.org/10.1016/S0040-4039(01)89113-9.
a) Cortés, E.; Salmón, M.; Walls, F. Bol. Inst. Quim. Univ. Nal. Autón. Méx. 1965, 17, 19-33. b) Sánchez, I. H.; Larraza, M. I.; Basurto, F.; Yañez, R.; Avila, S.; Tovar, R.; Joseph-Nathan, P. Tetrahedron. 1985, 41, 2355-2359. DOI: https://doi.org/10.1016/S0040-4020(01)96630-X.
Joseph-Nathan, P.; Mendoza, V.; García, E. Tetrahedron. 1977, 33, 1573-1576. DOI: https://doi.org/10.1016/0040-4020(77)80163-4.
Woodward, R.B.; Hoffman, R. in: The Conservation of Orbital Symmetry, Academic Press, New York, 1970, 87. DOI: https://doi.org/10.1002/anie.196907811.
Barquera-Lozada, J.E.; Cuevas, G. J. Org. Chem. 2009, 74, 874-883. DOI: https://doi.org/10.1021/jo802445n.
Barquera-Lozada, J.E.; Quiroz-Garcia B.; Quijano, L.; Cuevas, G. J. Org. Chem. 2010, 75, 2139-2146. DOI: https://doi.org/10.1021/jo902170w.
Aguilar-Martínez, M.; Bautista-Martínez, J. A.; Macías-Ruvalcaba, N.; González, I.; Tovar, E.; Marín del Alizal, T.; Collera, O.; Cuevas, G. J. Org. Chem. 2001, 66, 8349-8363. DOI: https://doi.org/10.1021/jo010302z.
Joseph-Nathan, P. in: El deuterio, mi pequeño y valioso ayudante para estudiar productos naturales, en Paredes-López, O.; Estrada-Orihuela, S (eds.) Aportaciones científicas y humanísticas mexicanas en el siglo XX. Fondo de Cultura Económica. 2008, 435.
Lowry, T.H.; Richardson, K.S. in: Mechanism and Theory in Organic Chemistry, 2a. Ed., Harper & Row: New York. 1976.
Zepeda, L.G.; Burgueño-Tapia, E.; Pérez-Hernández, N.; Cuevas, G.; Joseph-Nathan, P. Reson. Chem. 2013, 51, 245-250. DOI: https://doi.org/10.1002/mrc.3940.
Liu, F.; Paton, R.S.; Kim, S.; Liang, Y.; Houk, K.N. J. Am. Chem. Soc. 2013, 135, 15642–15649. DOI: https://doi.org/10.1021/ja408437u.
Bader, R. F. W. in: Atoms in Molecules.A Quantum Theory; Clarendon Press. Oxford, 1990. DOI: https://doi.org/10.1093/oso/9780198551683.001.0001
Keith, T.A., Version (13.11.04), TK Gristmill Software, Overlan, Oveland Park KS, USA 2013.(aim.tkgristmill.com).
Joseph R. Lane, J. C.-G.; Piquemal, J.-P.; Miller, B. J.; Kjaergaard, H. G. J. Chem. Theory Comput. 2013, 9, 3263-3266. DOI: https://doi.org/10.1021/ct400420r.
Boto, R.A.; Peccati, F.; Laplaza, R.; Quan, C.; Carbone, A.; Piquemal, J-P.: Maday, Y.; Contreras-García. J.. J. Chem. TheoryComput. 2020, 7, 4150-4158. DOI: https://doi.org/10.1021/acs.jctc.0c00063.
Frisch, M.J.; Trucks, G. W.; Schlegel, H. B.; Scuseria, G. E.; Robb, M. A.; Cheeseman, J. R.; Scalmani G.; Barone, V.; Mennucci, B.; Petersson, G. A.; Nakatsuji, H.; Caricato, M. ; Li, X.; Hratchian, H. P.; Izmaylov, A. F.; Bloino, J.; Zheng, G.; Sonnenberg, J. L.; Hada, M.; Ehara, M.; Toyota, K.; Fukuda, R.; Hasegawa, J.; Ishida, M.; Nakajima, T.; Honda, Y.; Kitao, O.; Nakai, H.; Vreven, T.; Montgomery, J. A.; Peralta, J. E.; Ogliaro, F.; Bearpark M.; Heyd, J. J.; Brothers, E.; Kudin, K. N.; Staroverov, V. N.; Keith, T.; Kobayashi, R.; Normand, J.; Raghavachari, K.; Rendell, A.; Burant, J. C.; Iyengar, S. S.; Tomasi, J.; Cossi, M.; Rega, N.; Millam, J. M.; Klene, M.; Knox, J. E.; Cross, J. B.; Bakken, V.; Adamo, C.; Jaramillo, J.; Gomperts, R.; Stratmann, R. E.; Yazyev, O.; Austin, A. J.; Cammi, R.; Pomelli, C.; Ochterski, J. W.; Martin, R. L.; Morokuma, K.; Zakrzewski, V. G.; Voth, G. A.; Salvador, P.; Dannenberg, J. J.; Dapprich, S.; Daniels, A. D.; Farkas, O.; Foresman, J. B.; Ortiz, J. V.; Cioslowski, J.; Fox, D. J. Gaussian 09, Revision D.01, Gaussian, Inc., Wallingford CT, 2013.
Zhao, Y.; Truhlar, D.G. Acc. Chem. Res. 2008, 41 157–167; DOI: https://doi.org/10.1021/ar700111a
Sánchez, I. H.; Yañez, R.; Enríquez, R. J. Org. Chem. 1981, 46, 2818-2819. DOI: https://doi.org/10.1021/jo00326a052.
Sánchez, I.H.; Basurto, F.; Joseph-Nathan, P. J. Nat Prod. 1984, 47, 382-383. DOI: https://doi.org/10.1021/np50032a027.
Humphrey, W.; Dalke, A.; Schulten, K. J. Mol. Graphics. 1996, 14, 33–38. DOI: https://doi.org/10.1016/0263-7855(96)00018-5.

Downloads
Published
Issue
Section
License
Copyright (c) 2023 Fatima Montserrat Soto Suárez, Gabriel Cuevas , Luis Mauricio Murillo-Herrera, Eduardo Hernández-Huerta, Mariana Ortiz-Reynoso, Karla Ramírez-Gualito, Ramiro Felipe Quijano-Quiñones

This work is licensed under a Creative Commons Attribution-NonCommercial 4.0 International License.
Authors who publish with this journal agree to the following terms:
- Authors retain copyright and grant the journal right of first publication with the work simultaneously licensed under a Creative Commons Attribution License that allows others to share the work with an acknowledgement of the work's authorship and initial publication in this journal.
- Authors are able to enter into separate, additional contractual arrangements for the non-exclusive distribution of the journal's published version of the work (e.g., post it to an institutional repository or publish it in a book), with an acknowledgement of its initial publication in this journal.









