Chemical Composition of Essential Oils of Dahlia imperialis (Asteraceae) Growing Wild in Costa Rica
DOI:
https://doi.org/10.29356/jmcs.v66i4.1785Keywords:
Dahlia imperialis, essential oils, β-pinene, α-phellandrene, α-pinene, GC-MSAbstract
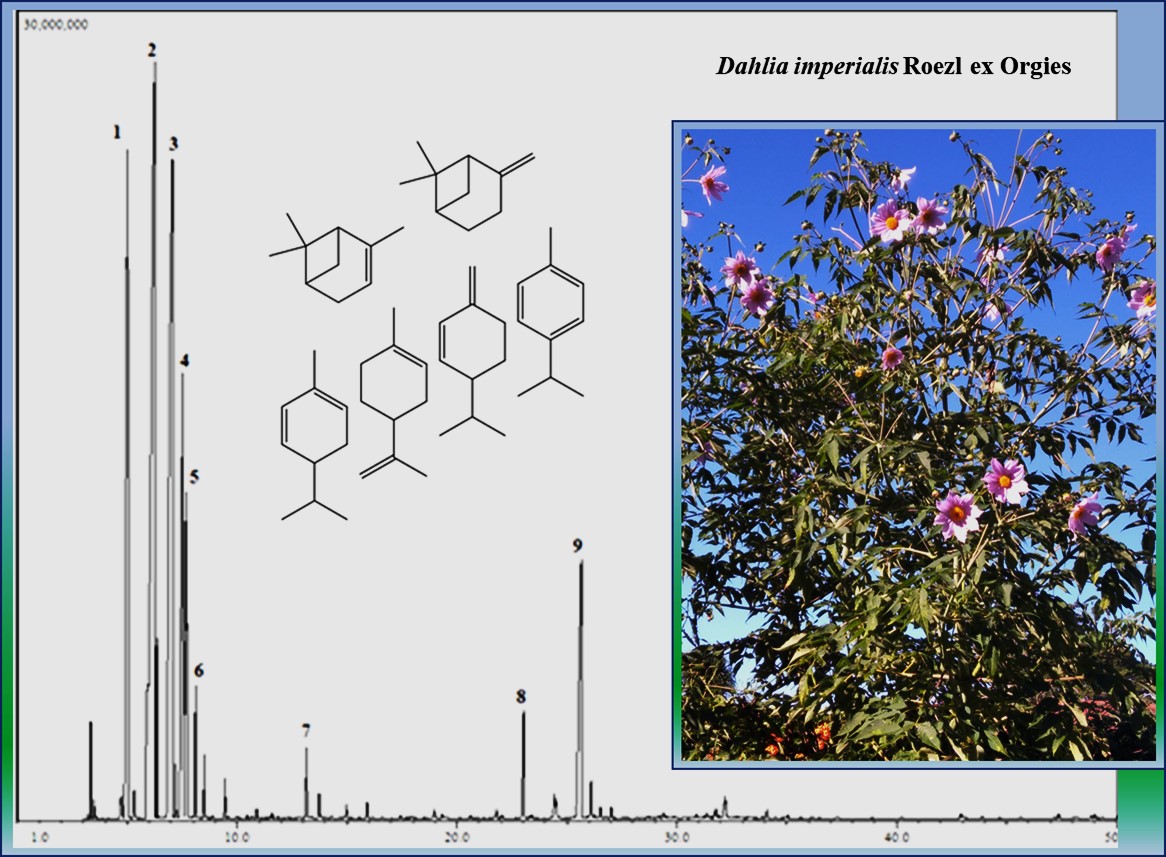
Abstract. Dahlia is a genus of flowering plants of about 35 to 40 species, distributed mainly in Mesoamerica. The aim of this work was to study the chemical composition of the leaflet and capitulum essential oils of D. imperialis growing wild in Costa Rica. The essential oils were obtained by hydrodistillation in a modified Clevenger apparatus. The chemical composition of the oils was performed by capillary gas chromatography with a flame detector (GC-FID) and gas chromatography-mass spectrometry (GC-MS) using the retention indices on a DB-5 type capillary column in addition to mass spectral fragmentation patterns. A total of 131 compounds were identified, accounting for 96.5-99.3 % of the total amount of the oils. The major constituents in the leaflet oil were β-pinene (35.2 %), α-phellandrene (21.9 %), α-pinene (18.0 %), p-cymene (8.3 %), limonene (4.3 %) and γ-muurolene (3.9 %). The major constituents in the capitulum (flower head) oil were β-pinene (27.7 %), α-phellandrene (26.2 %), α-pinene (12.4 %), β-phellandrene (6.6 %), limonene (5.6 %), (E)-β-ocimene (2.9 %), and germacrene D (2.2 %). This is the first report about the chemical composition of essential oils from D. imperialis.
Resumen. Dahlia es un género de plantas floríferas que consta de 35 a 40 especies, distribuidas principalmente en Mesoamérica. El objetivo de este trabajo fue determinar la composición química de los aceites esenciales de hojuelas e inflorescencias de D. imperialis creciendo silvestre en Costa Rica. La extracción del aceite se efectuó por hidrodestilación con un equipo Clevenger modificado. La composición química del aceite se analizó mediante las técnicas de cromatografía gaseoso-líquida con detector de ionización de llama (GC-FID) y de cromatografía gaseoso-líquida acoplada a un detector selectivo de masas (GC-MS). Se utilizaron índices de retención obtenidos en una columna capilar tipo DB-5 y se compararon con los patrones de fragmentación de masas. Se identificaron en total 131 compuestos, correspondientes a 96.5-99.3 % de los constituyentes totales. Los componentes mayoritarios del aceite de los foliolos fueron β-pineno (35.2 %), α-felandreno (21.9 %), α-pineno (18.0 %), p-cimeno (8.3 %), limoneno (4.3 %) y γ-muuroleno (3.9 %). Los componentes mayoritarios del aceite de los capítulos florales fueron β-pineno (27.7 %), α-felandreno (26.2 %), α-pineno (12.4 %), β-felandreno (6.6 %), limoneno (5.6 %), (E)-β-ocimeno (2.9 %) y germacreno D (2.2 %). Este es el primer informe acerca de la composición química de aceites esenciales de D. imperialis.
Downloads
References
Funk, V. A.; Susanna, A.; Stuessy, T. F.; Robinson H. Classification of Compositae. In Systematics, evolution, and biogeography of Compositae; Funk, V. A.; Susanna, A.; Stuessy, T. F.; Bayer, R. J., Eds.; IAPT: Vienna, Austria, 2009; Chap. 11, 171-189.
Panero, J. L.; Crozier, B. S. Asteraceae. Sunflowers, daisies. Version 27 January 2012. http://tolweb.org/Asteraceae/20780/2012.01.27 in The Tree of Life Web Project, http://tolweb.org/
Delgado, G. T.; Tamashiro, W. M.; Maróstica Junior, M. R.; Pastore, G. M. Plant Foods Hum. Nutr. 2013, 68, 222-228. DOI: https://doi.org/10.1007/s11130-013-0362-0.
Cicció, J. F. Rev. Biol. Trop. (Int. J. Trop. Biol.). 2004, 52, 853-857. Retrieved from https://revistas.ucr.ac.cr/index.php/rbt/article/view/15500.
Lim, T. K. Edible medicinal and non-medicinal plants. Vol. 7, Flowers. Springer: Dordrecht, Netherlands, 2014. DOI: https://doi.org/10.1007/978-94-007-7395-0.
Azurdia, C. Plantas mesoamericanas subutilizadas en la alimentación humana. El caso de Guatemala: una revisión del pasado hacia una solución actual. Consejo Nacional de Áreas Protegidas y Universidad de San Carlos de Guatemala, Dirección General de Investigación. Documento técnico No. 11-2016, 58-59.
Sorensen, P. D. Rhodora. 1969, 71, 309-365, 367-416. DOI: https://doi.org/10.1002/lipi.19690710503
Mera-Obando, L. M.; Bye-Boettl, R. Revista Digital Universitaria. 2006, 7, 3-11. Retrieved from http://www.revista.unam.mx/vol.7/num11/art90/nov_art90.pdf.
Mejía-Muñoz, J. M.; Luna-García, I. D.; Jiménez-Ruiz, E. F.; Sosa-Montes, E.; Flores-Espinosa, C.; Treviño-De Castro, G.; Reyes-Santiago, J. Acta Hortic. 2020, 1288, 103-107. DOI: https://doi.org/10.17660/ActaHortic.2020.1288.15.
Castro-Castro, A.; Rodríguez, A.; Vargas-Amado, G.; Harker, M. Rev. Mex. Biodivers. 2012, 83, 347-358. DOI: http://dx.doi.org/10.22201/ib.20078706e.2012.2.941. DOI: https://doi.org/10.22201/ib.20078706e.2012.2.941
Códice Badiano. Biblioteca Nacional de Antropología e Historia. INAH. México. https://mediateca.inah.gob.mx/repositorio/islandora/object/codice:851#page/1/mode/2up Nueva edición digitalizada del Códice Badiano. Fitoterapia.net. Retrieved from https://www.fitoterapia.net/noticias/nueva-edicion-digitalizada-codice-badiano-13898.html.
Mancheva, D. Libellus de medicinalibus Indorum herbis: la vida secreta de los nombres de las plantas de origen naua. In: De los descubrimientos a las taxonomías. La botánica y la zoología en la lengua española del Renacimiento a la Ilustración, De Beni, M., Ed.; Universitas Studiorum, Mantova, Italy, 2015, 21-45.
Reyes-Chilpa, R.; Guzmán-Gutiérrez, S. L.; Campos-Lara. M.; Bejar, E.; Osuna-Fernández, H. R.; Hernández-Pasteur, G. Bol. Latinoam. Caribe Plantas Med. Aromat. (BLACPMA). 2021, 20, 1-27. DOI: https://doi.org/10.37360/blacpma.21.20.1.1.
León, J.; Poveda, L. J. In Sánchez-Vindas, P. E. Ed., Nombres comunes de las plantas en Costa Rica, Editorial Guayacán: San José, Costa Rica, 2000.
Nash, D. L. Tribe V, Heliantheae. In Flora of Guatemala, Part XII, Nash, D. L.; Williams, L. O. Eds.; Fieldiana, Bot. 1976, 24, 503-570.
Hammel, B. Plantas ornamentales nativas de Costa Rica, Instituto Nacional de Biodiversidad (INBio): Santo Domingo de Heredia, Costa Rica, 1999.
Booth, S.; Johns, T.; López-Palacios, C. Y., Ecol. Food Nutr. 1993, 31, 127-145. DOI: https://doi.org/10.1080/03670244.1993.9991354.
Chízmar, C. (Ed.). Plantas comestibles de Centroamérica, Instituto Nacional de Biodiversidad, INBio: Santo Domingo de Heredia, Costa Rica, 2009.
House, P. R.; Lagos-Witte, S.; Ochoa, L.; Torres, C.; Mejía, T.; Rivas, M. Plantas medicinales comunes de Honduras, UNAH, CIMN-H, CID/CIIR, GTZ: Tegucigalpa, M.D.C., Honduras, 1995.
Lam, J. Phytochemistry. 1971, 10, 2227-2228. DOI: https://doi.org/10.1016/S0031-9422(00)97228-5.
Giannasi, D. E. Bull. Torrey Bot. Club. 1975, 102, 404-412. DOI: https://doi.org/10.2307/2484767.
Booth, S.; Bressani, R.; Johns, T. J. Food Compos. Anal. 1992, 5, 25-34. DOI: https://doi.org/10.1016/0889-1575(92)90005-5
Castro-Osorio, V. M. Caracterización nutricional, sensorial y antropológica de la hoja de tsoloj (Dahlia imperialis) para el consumo humano. Tesis de Maestría. Universidad de San Carlos de Guatemala, Guatemala, 2016. Retrieved from http://biblioteca.usac.edu.gt/tesis/06/06_3978.pdf.
Heywood, V. H.; Harborne, J. B.; Turner, B. L. An overture to the Compositae. In The biology and chemistry of the Compositae. Heywood, V. H.; Harborne, J. B.; Turner, B. L. Eds.; Academic Press Inc.: London, UK, 1977; Vol. 1, 17-18.
Evans, W. C. Trease and Evans Pharmacognosy, W. B. Saunders Ltd.: London, UK, 2002.
Wouters, R. Inulin. In Food stabilisers, thickeners, and gelling agents, Imeson, A. Ed.; Wiley-Blackwell: Oxford, UK, 2010; Chap. 10, 180-197. DOI: https://doi.org/10.1002/9781444314724.ch10
Bernal, B. H.; Calle, J.; Duarte, E. O.; Pinzón, R.; Velásquez, M. Rev. Col. Cienc. Quím. Farm. 2005, 34, 122-125.
Wan, X.; Guo, H.; Liang, Y.; Zhou, C.; Liu, Z.; Li, K.; Niu, F.; Zhai, X.; Wang, L. Carbohydrate Polymers. 2020, 246, 116589. DOI: https://doi.org/10.1016/j.carbpol.2020.116589.
van den Dool, H.; Kratz, P. D. J. Chromatogr. A 1963, 11, 463-471. DOI: https://doi.org/10.1016/s0021-9673(01)80947-x.
Stenhagen, E.; Abrahamsson, S.; McLafferty, F. W. Registry of Mass Spectral Data, John Wiley & Sons: New York, NY, USA, 1974.
Swigar, A. A.; Silvertein, R. M. Monoterpenes. Aldrich Chem. Co.: Milwaukee, WI, USA, 1981.
Adams, R. P. Identification of Essential Oil Components by Gas Chromatography/ Quadrupole Mass Spectrometry, 4th ed.; Allured: Carol Stream, IL, USA, 2007.
Wallace, W. E. (Dir.). 2019. Mass spectra (by NIST Mass Spec Data Center). In Linstrom, P. J.; Mallard, W. G. (Eds.), Chemistry WebBook, NIST Standard Reference Database Number 69, National Institute of Standards and Technology, Gaithersburg, MD, 20899, Available from http://webbook.nist.gov.
Cole, R. A.; Haber, W. A.; Setzer, W. N. Biochem. Syst. Ecol. 2007, 35, 877-886. DOI: https://doi.org/10.1016/j.bse.2007.06.013.
Vujisić, L. J.; Vučković, I.; Tešević, V.; Đoković, D.; Ristić, M. S.; Janaćković, P.; Milosavljević, S. Flavour Fragr. J. 2006, 21, 458-461. DOI: https://doi.org/10.1002/ffj.1681.
Díaz, C.; Quesada, S.; Brenes, O.; Aguilar, G.; Cicció, J. F. Nat. Prod. Res. 2008, 22, 1521–1534. DOI: https://doi.org/10.1080/14786410701848154.
Cicció, J. F. J. Essent. Oil Res. 2004, 16, 353-355. DOI: https://doi.org/10.1080/10412905.2004.9698740.
Chaverri, C.; Cicció, J. F. Bol. Latinoam. Caribe Plantas Med. Aromat. (BLACPMA). 2015, 14, 355-363. Retrieved from https://www.blacpma.usach.cl/sites/blacpma/files/articulo_2_-_968_-_355_-_363.pdf.
Chaverri, C.; Cicció, J. F. J. Essent. Oil Res. 2007, 19, 439-443. DOI: https://doi.org/10.1080/10412905.2007.9699946.
Chaverri, C.; Díaz, C.; Cicció, J. F. J. Braz. Chem. Soc. 2011, 22, 741-745. DOI: https://doi.org/10.1590/S0103-50532011000400018.
Cicció, J. F.; Chaverri, C. Quím. Nova 2008, 31, 605-609. DOI: https://doi.org/10.1590/S0100-40422008000300027.
Chaverri, C.; Díaz, C.; Cicció, J. F. Nat. Prod. Commun. 2011, 6, 145-148. DOI: https://doi.org/10.1177/1934578X1100600135.
Winnacker, M. Angew. Chem. Int. Edit. 2018, 57, 14362-14371. DOI: https://doi.org/10.1002/anie.201804009.
Salehi, B.; Upadhyay, S.; Orhan, I. E.; Jugran, A. K.; Jayaweera, S. L. D.; Dias, D. A.; Sharopov, F.; Taheri, Y.; Martins, N.; Baghalpour, N.; Cho, W. C.; Sharifi-Rad, J. Biomolecules. 2019, 9, 738. DOI: https://doi.org/10.3390/biom9110738.
Allenspach, A.; Steuer, C. Phytochemistry. 2021, 190, 112857. DOI: https://doi.org/10.1016/j.phytochem.2021.112857.
Bettaieb, I.; Bourgou, S.; Sriti, J.; Msaada, K.; Limam, F.; Marzouk, B. J. Sci. Food Agric. 2011, 91, 2100-2107. DOI: https://doi.org/10.1002/jsfa.4513
Satyal, P.; Murray, B. L.; McFeeters, R. L.; Setzer, W. N. Foods. 2016, 5, 70. DOI: https://doi.org/10.3390/foods5040070.
Başer, K. H. C.; Özek, T.; Tűmen, G.; Sezic, E. J. Essent. Oil Res. 1993, 5, 619-623. DOI: https://doi.org/10.1080/10412905.1993.0698294. DOI: https://doi.org/10.1080/10412905.1993.9698294
Balahbib, A.; El Omari, N.; El Hachlafi, N.; Lakhdar, F.; El Menyiy, N.; Salhi, N.; Mrabbti, H. N.; Bakrim, S.; Zengin, G.; Bouyahya, A. Food Chem. Toxicol. 2021, 153, 112259. DOI: https://doi.org/10.1016/j.fct.2021.112259.
Adams, T. B.; Gavin, C. L.; McGowen, M. M.; Waddell, W. J. S.; Cohen, M.; Feron, V. J.; Marnett, L. J.; Munro, I. C.; Portoghese, P. S.; Rietjens, I. M. C. M.; Smith. R. L. Food Chem. Toxicol. 2011, 49, 2471-2494. DOI: https://doi.org/10.1016/j.fct.2011.06.011.
Wang, D. C.; Qiu, D. R.; Shi, L. N.; Pan, H. Y.; Li, Y. W.; Sun, J. Z.; Xue, Y. J.; Wei, D. S.; Li, X.; Zhang, Y. M.; & Qui, J. C. Nat. Prod. Res. 2015, 29,1748-1751. DOI: https://doi.org/10.1080/14786419.2014.998218.
Maman, N., Iteleu, B. M., Azimbaeva, G. E., & Dzhiembaev, B. Z. Bulletin of Kazakh National Women’s Teacher Training University. 2018, 3, 37-44. (In Kasakh). Retrieved from: https://vestnik.kazmkpu.kz/jour/article/view/57/58.

Downloads
Published
Issue
Section
License
Copyright (c) 2022 José F. Cicció, Carlos Chaverri

This work is licensed under a Creative Commons Attribution-NonCommercial 4.0 International License.
Authors who publish with this journal agree to the following terms:
- Authors retain copyright and grant the journal right of first publication with the work simultaneously licensed under a Creative Commons Attribution License that allows others to share the work with an acknowledgement of the work's authorship and initial publication in this journal.
- Authors are able to enter into separate, additional contractual arrangements for the non-exclusive distribution of the journal's published version of the work (e.g., post it to an institutional repository or publish it in a book), with an acknowledgement of its initial publication in this journal.