Mycelial Secondary Metabolites with Anti-proliferative Potential from the Sediment-associated Fungus Acremonium persicinum
DOI:
https://doi.org/10.29356/jmcs.v70i1.2382Keywords:
Bioprospecting, microscopic fungi, anti-proliferative fungal compoundsAbstract
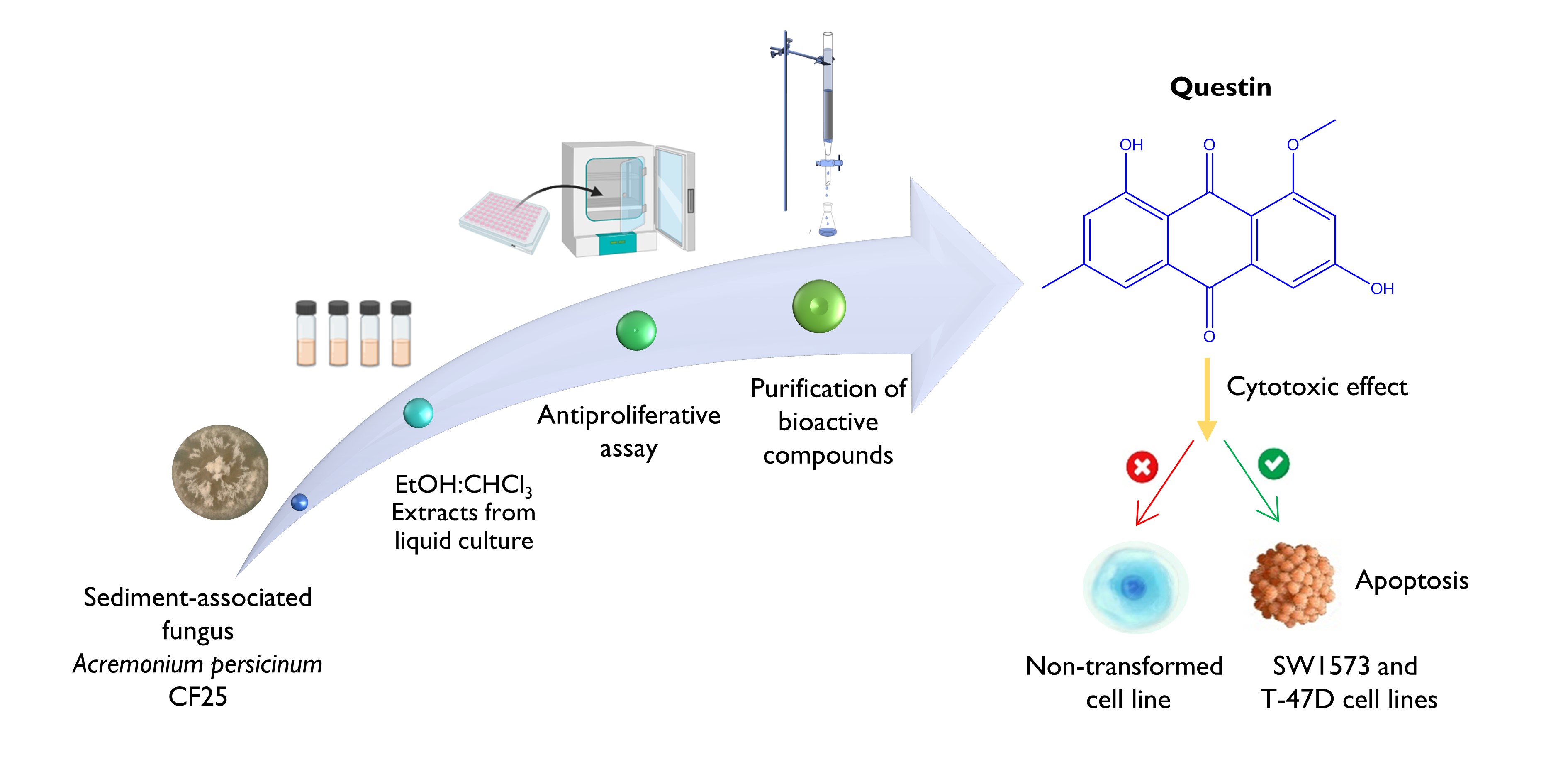
Abstract. Fungi associated with marine organisms, sediments and the mangrove rhizosphere are a promising source of bioactive compounds. However, lagoon-craters-associated fungi have been little explored. Therefore, this work reports on the mycelial secondary metabolites of the liquid culture of Acremonium persicinum CF25 isolated from the sediment of an alkaline lagoon-crater as having an anti-proliferative potential. In this way, from the biomass generated in 50 L of A. persicinum CF25 culture, 4 extracts of intermediate polarity were obtained, of which fractions F3 and F4 showed anti-proliferative potential with values of [GI50=µg/mL] equal to F3 (7.8, 13.0, 9.6, 11.0, 8.9, 21.0) and F4 (21.0, 35.0, 27.0, 27.0, 18.0, 27.0) against human solid tumor cell lines [A549, HBL-100, HeLa, SW1573, T-47D, WiDr], respectively. From the purification of F3, the sterols ergosterol, ergosterol peroxide and cerevisterol were isolated, while from F4 the anthraquinone known as questin was obtained. Questin presented a greater anti-proliferative effect against the A549 lung cancer and HeLa cervical cancer cell lines [GI50=μM] of 27.0 and 31.0, respectively. In addition, questin was shown to induce cell death by apoptosis, with a high selectivity index in SW1573 and T-47D tumor cells. Finally, these results support the importance of bioprospecting studies in ecosystems such as alkaline lagoon-craters, since they are a good source of microorganisms from which it is possible to obtain bioactive compounds.
Resumen. Los hongos asociados a organismos marinos, los sedimentos y la rizosfera de manglares son una fuente prometedora de compuestos bioactivos. Sin embargo, los hongos asociados lagunas cráter han sido poco explorados. Por ello, en este trabajo se reportan los metabolitos secundarios con potencial antiproliferativo obtenidos a partir del cultivo líquido miceliar de Acremonium persicinum CF25 aislado del sedimento de una laguna cráter alcalina. De esta manera, a partir de la biomasa generada en 50 L de cultivo de A. persicinum CF25, se obtuvieron 4 extractos de polaridad intermedia, de los cuales las fracciones F3 y F4 mostraron potencial antiproliferativo con valores de [GI50=µg/mL] correspondientes para F3 (7.8, 13.0, 9.6, 11.0, 8.9, 21.0) y F4 (21.0, 35.0, 27.0, 27.0, 18.0, 27.0) contra líneas celulares de tumores sólidos humanos [A549, HBL-100, HeLa, SW1573, T-47D, WiDr], respectivamente. De la purificación de F3 se aislaron los esteroles ergosterol, peróxido de ergosterol y cerevisterol, mientras que de F4 se obtuvo la antraquinona conocida como questina. Esta presentó mayor efecto antiproliferativo frente a las líneas celulares de cáncer de pulmón A549 y cáncer de cérvix HeLa [GI50=μM] de 27.0 y 31.0, respectivamente. Además, se demostró que questina induce muerte celular por apoptosis, con un índice alto de selectividad en células tumorales SW1573 y T-47D. Finalmente, estos resultados respaldan la importancia de los estudios de bioprospección en ecosistemas como lagunas-cráter alcalinos, ya que son una fuente potencial de microorganismos de los que es posible obtener compuestos bioactivos.
Downloads
References
1. Olivo-Flores, K. G.; Couttolenc, A.; Suárez-Medellín, J.; Trigos, Á.; Espinoza, C. Electron. J. Biotechnol. 2024, 72, 12-19. DOI: https://doi.org/https://doi.org/10.1016/j.ejbt.2024.08.001
2. Wang, Z.; Qader, M.; Wang, Y.; Kong, F.; Wang, Q.; Wang, C. Front. Mar. Sci. 2023, 10, 1232891. DOI: https://doi.org/10.3389/fmars.2023.1232891
3. Lin, X.; Zhou, X.; Wang, F.; Liu, K.; Yang, B.; Yang, X.; Peng, Y.; Liu, J.; Ren, Z.; Liu, Y. Marine Drugs. 2012, 10,106-15. DOI: https://doi.org/10.3390/md10010106
4. Liu, D.; Yan, L.; Ma, L.; Huang, Y.; Pan, X.; Liu, W.; Lv, Z. Arch. Pharm. Res. 2015, 38, 1038–1043. DOI: https://doi.org/10.1007/s12272-014-0371-z
5. Suciati; Fraser, J. A.; Lambert, L. K.; Pierens, G. K.; Bernhardt, P. V.; Garson, M. J. J. Nat. Prod. 2013, 76, 1432-1440. DOI: https://doi.org/10.1021/np4002114
6. Alves, A. J. S.; Pereira, J. A.; Dethoup, T.; Cravo, S.; Mistry, S.; Silva, A. M. S.; Pinto, M. M. M.; Kijjoa, A. Marine Drugs. 2019, 17, 379. DOI: https://doi.org/10.3390/md17060379
7. Garson, M. J.; Hehre, W.; Pierens, G. K.; Suciati. Molecules. 2017, 22, 521. DOI: https://doi.org/10.3390/molecules22040521
8. Wu, P.; Yao, L.; Xu, L.; Xue, J.; Wei, X. J. Nat. Prod. 2015, 78, 2161–2166. DOI: https://doi.org/10.1021/np501037x
9. Nakamura, I.; Yoshimura, S.; Masaki, T.; Takase, S.; Ohsumi, K.; Hashimoto, M.; Furukawa, S.; Fujie, A. J. Antibiot. 2017, 70, 45-51. DOI: https://doi.org/10.1038/ja.2016.107
10. Wang, C.; Wu, P.; Yao, L.; Xue, J.; Xu, L.; Li, H.; Deng, W.; Wei, X. J. Antibiot. 2018, 71, 927-938. DOI: https://doi.org/10.1038/s41429-018-0086-3
11. Luo, M.; Zang, R.; Wang, X.; Chen, Z.; Song, X.; Ju, J.; Huang, H. J. Nat. Prod. 2019, 82, 2594-2600. DOI: https://doi.org/10.1021/acs.jnatprod.9b00545
12. Cheng, Z.; Zhao, J.; Liu, D.; Proksch, P.; Zhao, Z.; Lin, W. J. Nat. Prod. 2016, 79, 1035-1047. DOI: https://doi.org/10.1021/acs.jnatprod.5b01103
13. Nozawa, Y.; Sakai, N.; Matsumoto, K.; Mizoue, K. J. Antibiot. 2002, 55, 629-34. DOI: https://doi.org/10.7164/antibiotics.55.629
14. Qin, Y.; Lu, H.; Qi, X.; Lin, M.; Gao, C.; Liu, Y.; Luo, X. J. Fungi. 2024, 10, 37. DOI: https://doi.org/10.3390/jof10010037
15. Crous, P. W.; Verkley, G. J. M.; Groenewald, J. Z.; Samson, R. A., in: Fungal Biodiversity. CBS Laboratory Manual Series 1; Westerdijk Fungal Biodiversity Institute: Utrecht, 2009, 141-144.
16. Kjer, J.; Debbab, A.; Aly, A. H.; Proksch, P. Nat. Protoc. 2010, 5, 479-490. DOI: https://doi.org/10.1038/nprot.2009.233
17. Franceschy, C.; Espinoza, C.; Padrón, J. M.; Landa-Cadena, G.; Norte, M.; Fernández, J. J.; Shnyreva, A.; Trigos, Á. Nat. Prod. Res. 2021, 35, 2895-2898. DOI: https://doi.org/10.1080/14786419.2019.1669032
18. Espinoza, C.; Couttolenc, A.; Fernández, J. J.; Norte, M.; Plata, G. B.; Padrón, J. M.; Shnyreva, A.; Trigos, Á. J. Mex. Chem. Soc. 2016, 60, 79-82. DOI: https://doi.org/10.29356/jmcs.v60i2.77
19. Yurchenko, A. N.; Smetanina, O. F.; Kirichuk, N. N.; Yurchenko, E. A.; Afiyatullov, S. S. Chem. Nat. Compd. 2014, 49, 1123-1124. DOI: https://doi.org/10.1007/s10600-014-0836-9
20. Skehan, P.; Storeng, R.; Scudiero, D.; Monks, A.; McMahon, J.; Vistica, D.; Warren, J. T.; Bokesch, H.; Kenney, S.; Boyd, M. R. J. Natl. Cancer Inst. 1990, 82, 1107-1112. DOI: https://doi.org/10.1038/nprot.2006.179
21. Monks, A.; Scudiero, D.; Skehan, P.; Shoemaker, R.; Paull, K.; Vistica, D.; Hose, C.; Langley, J.; Cronise, P.; Vaigro-Wolff, A. J. Natl. Cancer Inst. 1991, 83, 757-766. DOI: https://doi.org/10.1093/jnci/83.11.757
22. Prayong, P.; Barusrux, S.; Weerapreeyakul, N. Fitoterapia. 2008, 79, 598-601. DOI: https://doi.org/https://doi.org/10.1016/j.fitote.2008.06.007
23. Said, G.; Hou, X. M.; Liu, X.; Chao, R.; Jiang, Y. Y.; Zheng, J. Y.; Shao, C. L. Chem. Nat. Compd. 2019, 55, 531-533. DOI: https://doi.org/10.1007/s10600-019-02732-5
24. Xu, J.; Tan, H.; Chen, Y.; Li, S.; Guo, H.; Huang, Z.; Lia, H.; Gaob, X.; Liu, H.; Zhang, W. Chin Chem Lett. 2019, 30, 439-42. DOI: https://doi.org/10.1016/j.cclet.2018.09.018
25. Zhou, J.; Li, G.; Deng, Q.; Zheng, D.; Yang, X.; Xu, J. Nat. Prod. Res. 2018, 32, 2968-2972. DOI: https://doi.org/10.1080/14786419.2017.1395431
26. Hao, Y.; Wei, L.; Li, L.; Wang, Y.; Li, N.; Pan, Y.; Sun, Y. Nat. Prod. Res. 2022, 36, 5606-5613. DOI: https://doi.org/10.1080/14786419.2021.2022670
27. Deng, M.; Pu, Y.; Wan, Z.; Xu, J.; Huang, S.; Xie, J.; Zhou, X. Phytochemistry. 2023, 212, 113716. DOI: https://doi.org/https://doi.org/10.1016/j.phytochem.2023.113716
28. Liu, T.; Zhu, W.; Yang, X.; Chen, L.; Yang, R.; Hua, Z.; Li, G. Anal. Chem. 2009, 8, 2410-3. https://doi.org/10.1021/ac801267s
29. Vermes, I.; Haanen, C.; Steffens-Nakken, H.; Reutellingsperger, C. J. Immunol. Methods. 1995, 184, 39-51. DOI: https://doi.org/10.1016/0022-1759(95)00072-I
30. Crowley, L. C.; Marfell, B. J.; Scott, A. P.; Waterhouse, N. J. Cold Spring Harb. Protoc. 2016, 2016, 953-957. DOI: https://doi.org/10.1101/pdb.prot087288
31. Fisher, D. E. Apoptosis in Cancer Therapy: Crossing the Threshold. Cell. 1994, 78 (4), 539–542. DOI: https://doi.org/10.1016/0092-8674(94)90518-5
32. Lica, J. J.; Wieczór, M.; Grabe, G. J.; Heldt, M.; Jancz, M.; Misiak, M.; Gucwa, K.; Brankiewicz, W.; Maciejewska, N.; Stupak, A.; Bagiński, M.; Rolka, K.; Hellmann, A.; Składanowski, A. Int. J. Mol. Sci. 2021, 22, 4931. DOI: https://doi.org/10.3390/ijms22094931
33. Jiang, S.; Fan, J.; Wang, Q.; Ju, D.; Feng, M.; Li, J.; Guan, Z.; An, D.; Wang, X.; Ye, L. Phytomedicine. 2016, 23, 243-52. DOI: https://doi.org/10.1016/j.phymed.2016.01.010
34. Guo, L.; Zhang, F.; Wang, X.; Chen, H.; Wang, Q.; Guo, J.; Cao, X.; Wang, L. 3 Biotech. 2019, 9, 1-7. DOI: https://doi.org/10.1007/s13205-018-1535-1
35. Dulay, R.; Valdez, B.; Chakrabarti, S.; Dhillon, B.; Cabrera, E.; Kalaw, S.; Reyes, R. Int. J. Med. Mushrooms. 2022, 24, 83-95. DOI: https://doi.org/10.1615/intjmedmushrooms.2022045306
36. Hao, J.; Zhang, X.; Yu, W.; Wang, R.; Xue, Z.; Kou, X. Int. J. Med. Mushrooms. 2017, 19, 839–848. DOI: https://doi.org/10.1615/IntJMedMushrooms.2017024372
37. An, X.; Feng, B. M.; Chen, G.; Chen, S. F.; Wang, H. F.; Pei, Y. H. Chin. J. Nat. Med. 2016, 14 , 934–938. DOI: https://doi.org/10.1016/S1875-5364(17)30019-5
38. Wang, X. Y.; Ye, X. S.; Gao, S.; Liu, J. X.; Tian, W. J.; Wang, G. H.; Chen, H. F.; Lin, T. Fitoterapia. 2020, 147, 104766. DOI: https://doi.org/10.1016/j.fitote.2020.104766
39. Luo, X.; Cai, G.; Guo, Y.; Gao, C.; Huang, W.; Zhang, Z.; Lu, H.; Liu, K.; Chen, J.; Xiong, X.; Lei, J.; Zhou, X.; Wang, J.; Liu, Y. J. Med. Chem. 2021, 64, 13918–13932. DOI: https://doi.org/10.1021/acs.jmedchem.1c01402
40. Alfatah, M.; Wong, J. H.; Nge, C. E.; Kong, K. W.; Low, K. N.; Leong, C. Y.; Crasta, S.; Munusamy, M.; Chang, A. M. L.; Hoon, S.; Ng, S. B.; Kanagasundaram, Y.; Arumugam, P. Sci. Rep. 2019, 9, 710. DOI: https://doi.org/10.1038/s41598-018-35979-z
41. Liu, F.; Luo, K.; Yu, Z.; Co, N.; Wu, S.; Wu, P.; Fung, K.; Kwok, T. Chem. Biol. Interact. 2009, 181, 168–174. DOI: https://doi.org/10.1016/j.cbi.2009.07.008
42. Hanahan, D.; Weinberg, R. A. Hallmarks of Cancer: The Next Generation. Cell. 2011, 144, 646–674. DOI: https://doi.org/10.1016/j.cell.2011.02.013
43. Kang, J. H.; Jang, J. E.; Mishra, S. K.; Lee, H. J.; Nho, C. W.; Shin, D.; Jin, M.; Kim, M. K.; Choi, C.; Oh, S. H. J. Ethnopharmacol. 2015, 173, 303–312. DOI: https://doi.org/10.1016/j.jep.2015.07.030
44. Dong, W. G.; Wang, Z. X.; Feng, X. L.; Zhang, R. Q.; Shen, D. Y.; Du, S.; Gao, J. M.; Qi, J. Microbiol. Spectr. 2022, 10, e0243922. DOI: https://doi.org/10.1128/spectrum.02439-22

Downloads
Published
Issue
Section
License
Copyright (c) 2025 César Espinoza, César Franceschy, Alan Couttolenc, María de la Soledad Lagunes-Castro, José M. Padrón, José J. Fernández, Ángel Trigos

This work is licensed under a Creative Commons Attribution-NonCommercial 4.0 International License.
Authors who publish with this journal agree to the following terms:
- Authors retain copyright and grant the journal right of first publication with the work simultaneously licensed under a Creative Commons Attribution License that allows others to share the work with an acknowledgement of the work's authorship and initial publication in this journal.
- Authors are able to enter into separate, additional contractual arrangements for the non-exclusive distribution of the journal's published version of the work (e.g., post it to an institutional repository or publish it in a book), with an acknowledgement of its initial publication in this journal.