Insecticidal and repellent effects of Pelargonium graveolens L'Hér., Salvia rosmarinus Spenn., and Mentha × piperita L. essential oils against Dendroctonus mexicanus (Coleoptera: Curculionidae)
DOI:
https://doi.org/10.29356/jmcs.v70i1.2484Keywords:
Insecticide, repellency, essential oil, bark beetle, AChEAbstract
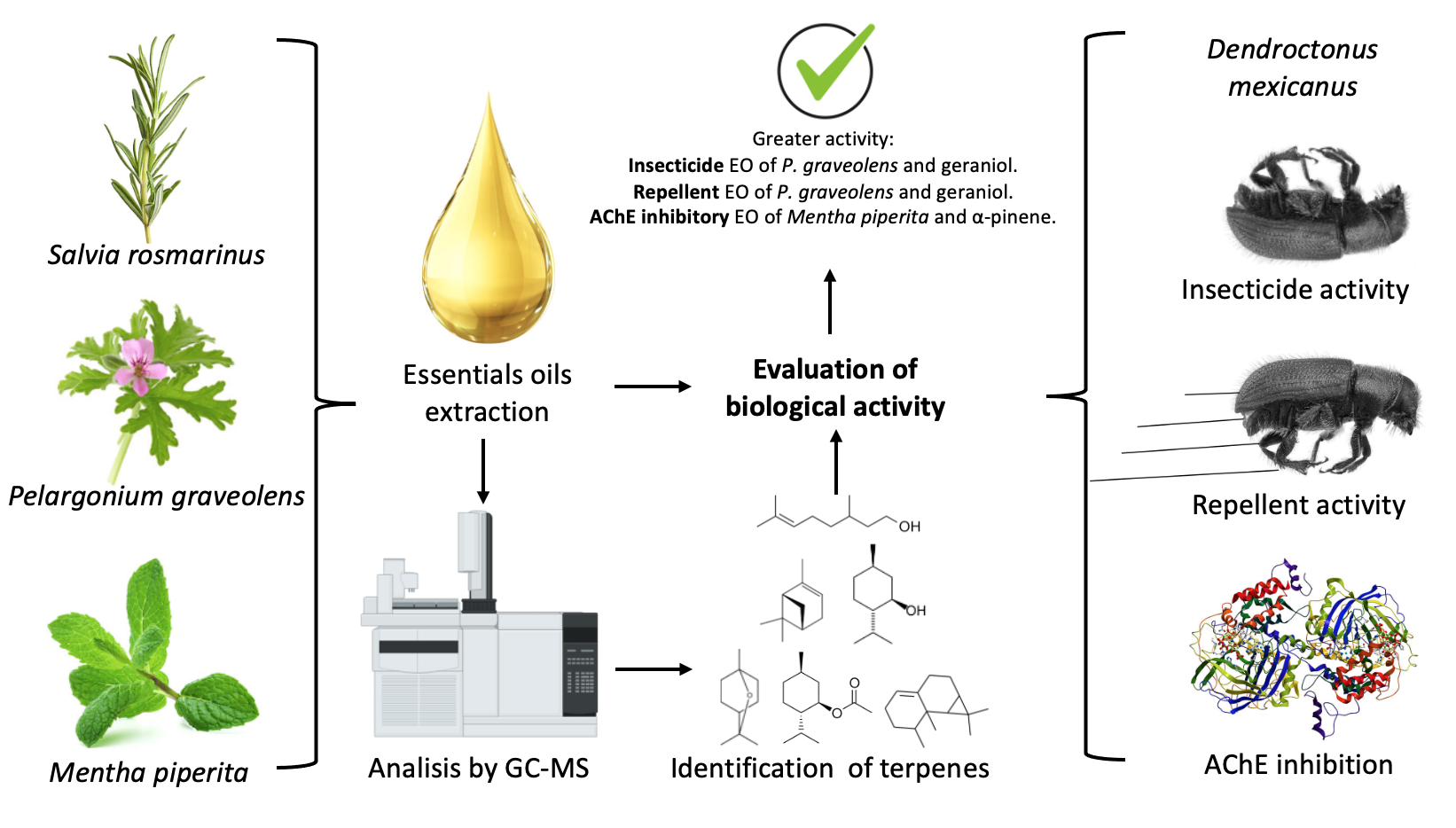
Abstract. Bark beetles are insects that help regenerate coniferous forests; however, they can become a devastating pest, causing widespread tree mortality. In Mexico, these insects are one of the most important pests. The use of synthetic insecticides has resulted in environmental damage, human health risks, and increased pest resistance. Aromatic plants offer a potential alternative for forest pest management. This study evaluated the insecticidal and repellent activities of essential oils (EOs) from Pelargonium graveolens, Salvia rosmarinus, and Mentha × piperita against Dendroctonus mexicanus. EOs were extracted through steam distillation, identified by gas chromatography-mass spectrometry (GC-MS), and tested for bioactivity. The major constituents were citronellol (54.0 %) and trans-menthone (9.9 %) in P. graveolens; 1,8-cineole (32.4 %) and α-pinene (30.7 %) in S. rosmarinus, and menthol (37.4 %) and menthyl acetate (20.1 %) in M. × piperita. The terpene geraniol exhibited the strongest insecticidal effect (LD50= 14.82 µg/insect). P. graveolens EO showed significant repellency at 80 μg/cm2 (50 %). In the acetylcholinesterase inhibition assay, α-pinene showed the most potent effect (IC50=3.49 mg/mL). These findings suggest that the tested EOs are promising natural alternatives to synthetic insecticides for managing D. mexicanus infestations.
Resumen. Los escarabajos descortezadores son insectos que ayudan a la regeneración de bosques de coníferas, sin embargo, pueden convertirse en una plaga devastadora, provocando la mortalidad generalizada de árboles. En México estos insectos son uno de los agentes de disturbio más importantes. El uso de insecticidas sintéticos ha generado daños ambientales, riesgos para la salud humana y aumento de la resistencia de plagas. Las plantas aromáticas ofrecen una alternativa potencial para el manejo de plagas forestales. Este estudio evaluó la actividad insecticida y repelente de los aceites esenciales (AE) de Pelargonium graveolens, Salvia rosmarinus y Mentha × piperita contra Dendroctonus mexicanus. Los AE se extrajeron mediante destilación al vapor, se identificaron por cromatografía de gases-espectrometría de masas y se analizó su bioactividad. Los componentes principales fueron citronelol (54.0 %) y trans-mentona (9.9 %) en el AE de P. graveolens; 1,8-cineol (32.4 %) y α-pineno (30.7 %) en el AE de S. rosmarinus, y mentol (37.4 %) y acetato de mentilo (20.1 %) en el AE de M. × piperita. El terpeno geraniol mostró el efecto insecticida más potente (DL50= 14.82 μg/insecto). El AE de P. graveolens mostró una repelencia significativa a 80 μg/cm² (50 %). En el ensayo de inhibición de la acetilcolinesterasa, el α-pineno mostró el efecto más potente (CI50= 3.49 mg/mL). Estos hallazgos sugieren que los AEs analizados son alternativas naturales prometedoras a los insecticidas sintéticos para el control de infestaciones de D. mexicanus.
Downloads
References
1. Sáenz-Romero, C.; Mendoza-Maya, E; Gómez-Pineda, E; Blanco-García, A; Endara-Agramont, A; Lindig-Cisneros, R; López-Upton, J.; Trejo-Ramírez, O.; Wehenkel, C.; Cibrián-Tovar, D.; Flores-López, C.; Plascencia-González, A.; Vargas-Hernández, J. Can. J. For. Res. 2020, 50, 843-854. DOI: https://doi.org/10.1139/cjfr-2019-0329
2. Dhar, A.; Comeau, P.; Karst, J.; Pinno, B.; Chang, S.; Naeth, M.; Vassov, R.; Bampfylde, C. Environ. Rev. 2018, 26, 286-298. DOI: https://doi.org/10.1139/er-2017-009 DOI: https://doi.org/10.1139/er-2017-0091
3. Negrón, J. F. Insects. 2020, 11, 112. DOI: https://doi.org/10.3390/insects11020112
4. Six, D.; Bracewell, R., in: Bark beetles: biology and ecology of native and invasive species, Academic Press: San Diego, 2015.
5. Armendáriz-Toledano, F.; Zúñiga, G. J. Insect Sci. 2017, 34, 1-15. DOI: https://doi.org/10.1093/jisesa/iex009
6. Fettig, C. J.; Audley, J. P.; Homicz, C. S.; Progar, R. A. Forest. 2023, 14, 757. DOI: https://doi.org/10.3390/f14040757
7. Davis, T. S.; Mann, A. J.; Malesky, D.; Jankowski, E.; Bradley, C. Environ. Entomol. 2018, 47, 594-602. DOI: https://doi.org10.1093/ee/nvy036 DOI: https://doi.org/10.1093/ee/nvy036
8. Sullivan, B. T. Forest. 2024, 15, 642. DOI: https://doi.org/10.3390/f15040642
9. Aznar-Alemany, Ò.; Eljarrat, E., in: The Handbook of Environmental Chemistry, Springer, Berlin, 2020. 92, 1-21. DOI: https://doi.org/10.1007/698_2019_435.
10. Gokturk, T.; Kordali, S.; Calmasur, O.; Tozlu, G. Fresnius Environ. Bull. 2011, 20, 2365-2370.
11. Lubojacký, J.; Holuša, J. Int. J. Pest Mang. 2014, 60, 153-159. DOI: http://dx.doi.org/10.1080/09670874.2014.944610 DOI: https://doi.org/10.1080/09670874.2014.944610
12. Rivera-Dávila, O. L.; Sánchez-Martínez, G.; Rico-Martínez, R. Chemosphere. 2021, 263, 128375. DOI: https://doi.org/10.1016/j.chemosphere.2020.128375
13. Peixoto, M.; Costa-Júnior, L.; Blank, A.; Da Silva Lima, A.; Menezes, T.; De Alexandria, D.; Alves, P.; De Holnda, S.; Bacci, L.; De Fátima, M. Vet. Parasitol. 2015, 210, 118-122. DOI: https://doi.org/10.1016/j.vetpar.2015.03.010
14. Rattan, R. Crop Prot. 2010, 29, 913-920. DOI: https://doi.org/10.1016/j.cropro.2010.05.008
15. Isman, M. Annu. Rev. Entomol. 2020, 65, 233-249. DOI: https://doi.org/10.1146/annurev-ento-011019-025010
16. Marrone, P. Pest Manag. Sci. 2019, 75, 2325-2340. DOI: https://doi.org/10.1002/ps.5433
17. Abdelatti, Z.; Hartbauer, M. J. Pest Sci. 2020, 93, 341-353. DOI: https://doi.org/10.1007/s10340-019-01169-7
18. Chaudhari, A. K.; Singh, V. K.; Kedia, A.; Das, S.; Dubey, N. K. Environ. Sci. Pollut. Res. 2021, 28, 18918-18940. DOI: https://doi.org/10.1007/s11356-021-12841-w
19. Jahanian, H.; Kahkeshani, N.; Sanei-Dehkordi, A.; Isman, M. B.; Saeedi, M.; Khanavi, M. Int. J. Pest Manag. 2022, 70, 818-863.DOI: https://doi.org/10.1080/09670874.2022.2046889.
20. Patiño-Bayona, W.; Nagles, L.; Bustos, J.; Delgado, W.; Herrera, E.; Suárez, L.; Prieto-Rodríguez, J.; Patiño-Ladino, O. Insects. 2021, 12, 532. DOI: https://doi.org/10.3390/insects12060532
21. Shawer, R.; El-Shazly, M.; Khider, A.; Baeshen, R.; Hikal, W.; Kordy, A. Molecules. 2020, 27, 4383. DOI: https://doi.org/10.3390/molecules27144383
22. Fouad, H.; Da Câmara, C.; De Moraes, M.; Tavares, W.; Legaspi, J.; Zanuncio, J. Dose-response. 2023, 20, 21. DOI: https://doi.org/10.1177/15593258231210263
23. Singh, P.; Pandey, A. K. Front. Plant Sci. 2018, 9, 1295. DOI: https://doi.org/10.3389/fpls.2018.01295
24. Gharsan, F. N.; Kamel, W. M.; Alghamdi, T. S.; Alghamdi, A. A.; Althagafi, A. O.; Aljassim, F. J.; Al-ghamdi, S. N. Ind. Crops Prod. 2022, 184, 115024 DOI: https://doi.org/10.1016/j.indcrop.2022.115024
25. M’hamdi, Z., Davì, Z. F.; Elhourri, M.; Amechrouq, A.; Mondello, F.; Cacciola, F.; Laganà Vinci, R.; Mondello, L.; Miceli, N.; Taviano, M. Molecules. 2024, 29, 4036. DOI: https://doi.org/10.3390/molecules29174036
26. Machalova, Z.; Sajfrtova, M.; Pavela, R.; Topiar, M. Ind. Crops Prod. 2015, 67, 310-317. DOI: https://doi.org/10.1016/j.indcrop.2015.01.070
27. Dos Santos, M.; Lima, A.; Farias, A.; Santana, A.; Prado, N.; Lourenção, A.; Bernardes, W.; Lopes, E.; Spotti, J. Entomol. Exp. Appl. 2024, 172, 768-776. DOI: https://doi.org/10.1111/eea.13461
28. Tabanca, N.; Wang, M.; Avonto, C.; Chittiboyina, A. G.; Parcher, J. F.; Carroll, J. F.; Kramer, M.; Khan, I. A. J. Agric. Food Chem. 2013, 61, 4101-4107. DOI: https://doi.org/10.1021/jf400246a
29. Jankowska, M.; Rogalska, J.; Wyszkowska, J.; Stankiewicz, M. Molecules. 2018, 23, 34. DOI: https://doi.org/10.3390/molecules23010034
30. López, M.; Pascual-Villalobos, M. Ind. Crops Prod. 2010, 31, 284-288. DOI: https://doi.org/10.1016/j.indcrop.2009.11.005
31. Houzi, G.; El abdali, Y.; Beniaich, G.; Chebaibi, M.; Taibi, M.; Elbouzidi, A.; Kaioua, S.; Asehraou, A.; Addi, M.; Chaabane, K.; Flouchi, R.; Allali, A.; Khal-Layoun, S. Scientifica. 2024, 2024, 5558041. DOI: https://doi.org/10.1155/2024/5558041
32. Krzyżowski, M.; Baran, B.; Łozowski, B.; Francikowski, J. Insects. 2020, 6, 344. DOI: https://doi.org/10.3390/insects11060344
33. Wu, Z.; Jin, C.; Chen, Y.; Yang, S.; Yang, X.; Zhang, D.; Xie, Y. Plants. 2023, 12, 4034. DOI: https://doi.org/10.3390/plants12234034
34. Aboelhadid, S.; Abdel-Baki, A.; Hassan, K.; Ibrahium, S.; Al-Quraishy, S.; Hassan, A.; Kamel, A. Pak. J. Zool. 2023, 56(5), 2067-2083. DOI: https://dx.doi.org/10.17582/journal.pjz/20220418100455 DOI: https://doi.org/10.17582/journal.pjz/20220418100455
35. Roman, S.; Voaides, C.; Babeanu, N. Plants. 2023, 12, 4123. DOI: https://doi.org/10.3390/plants12244123
36. Robustelli della Cuna, F.; Calevo, J.; Bari, E.; Giovannini, A.; Boselli, C.; Tava, A. Molecules. 2019, 21, 3878. DOI: https://doi.org/10.3390/molecules24213878
37. Adams, R., in: Identification of essential oil components by Gas Chromatography/Quadrupole Mass Spectroscopy, Carol Stream, Illinois, 2007.
38. Abbott, W. J. Econ. Entomol. 1925, 18, 265-267. DOI: https://doi.org/10.1093/jee/18.2.265a
39. Wang, S.; Lai, W.; Chu, F.; Lin, C.; Shen, S.; Chang, S. J. Wood Sci. 2006, 52, 522-526. DOI: https://doi.org/10.1007/s10086-006-0806-3
40. Dales, M., in: A review of plant materials used for controlling insect pests of stored products, NRI Bulletin 65, 1995.
41. Ellman, G.; Courtney, K.; Andres, V.; Featherstone, R. Biochem. Pharmacol. 1961, 7, 88-95. DOI: https://doi.org/10.1016/0006-2952(61)90145-9
42. Finney, D. J., in: Probit analysis, Cambridge University Press, Cambridge, UK, 1971.
43. Boukhatem, M. N.; Ferhat, M. A.; Kameli, A.; Saidi, F.; Kebir, H. T. J. Essent. Oil Res. 2013, 4, 330-337. DOI: https://doi.org/10.1080/10412905.2013.775080
44. Nieto, G.; Ros, G.; Castillo, J. Antioxidants. 2018, 7, 20. DOI: https://doi.org/10.3390/antiox7120020
45. Almeida, R. N.; Blank, A. F.; Oliveira Filho, J. G.; Silva, T. C.; Santana, A. S.; Santos, A. C. B.; et al. Sustain. Chem. Pharm. 2021, 24, 100536. DOI: https://doi.org/10.1016/j.scp.2021.100536
46. Golmohammadi, M.; Borghei, A.; Zenouzi, A.; Ashrafi, N.; Taherzadeh, M. Heliyon. 2018, 11, e00893. DOI: https://doi.org/10.1016/j.heliyon.2018.e00893
47. Annemer, S.; Farah, A.; Stambouli, H.; Assouguem, A.; Almutairi, M. H.; Sayed, A.A.; Peluso, I. Bouayoun T, Talaat Nouh NA, El Ouali Lalami A, Ez Zoubi Y. Molecules. 2022, 9, 2914. DOI: https://doi.org10.3390/molecules27092914 DOI: https://doi.org/10.3390/molecules27092914
48. Wafa, S. S. A. E.; El-Ashmawy, A. A.; Kassem, H. A. H.; Eissa, I. H.; Abu-Elghait, M.; Younis, N. A.; Younis, I. Y. Sci. Rep. 2023, 13, 19887. DOI: https://doi.org/10.1038/s41598-023-47170-0
49. Machiani, M. A.; Javanmard, A.; Morshedloo, M. R.; Maggi, F. J. Clean. Prod. 2018, 171, 529-537. DOI: https://doi.org/10.1016/j.jclepro.2017.10.062
50. Pang, X.; Feng, Y.; Qi, X.; Wang, Y.; Almaz, B.; Xi, C.; Du, S. Environ. Sci. Pollut. Res. 2020, 7, 7618-7627. DOI: https://doi.org/10.1007/s11356-019-07081-y
51. Tian, Y.; Hogsette, J. A.; Norris, E. J.; Hu, X. P. Insects. 2024, 6, 384. DOI: https://doi.org/10.3390/insects15060384
52. Mudrončeková, S.; Ferenčík, J.; Gruľová, D.; Barta, M. J. Pest Sci. 2019, 92, 595-608. DOI: https://doi.org/10.1007/s10340-018-1038-1
53. Takov, D.; Barta, M.; Nikolova, M.; Doychev, D.; Toshova, T.; Ostoich, P.; Pilarska, D. Baltic J. Coleopterol. 2023, 23, 139-158. DOI: https://doi.org/10.59893/bjc.23(2).001
54. Jayaram, C.; Chauhan, N.; Dolma, S.; Reddy, S. Toxin Rev. 2020, 1, 48-54. DOI: https://doi.org/10.1080/15569543.2020.1828471
55. Dolma, S.; Singh, P.; Reddy, S. Molecules. 2022, 27, 1967. DOI: https://doi.org/10.3390/molecules27061967
56. Trongtokit, Y.; Rongsriyam, Y.; Komalamisra, N.; Apiwathnasorn, C. Phytother. Res. 2005, 19, 303-309. DOI: https://doi.org/10.1002/ptr.1637
57. Maia, M. F.; Moore, S. J. Malar. J. 2011, 10 (Suppl 1), S11. DOI: https://doi.org/10.1186/1475-2875-10-S1-S11
58. Pavela, R. Ind. Crops Prod. 2014, 60, 247-258. DOI: https://doi.org/10.1016/j.indcrop.2014.06.030
59. Panthawong, A.; Nararak, J.; Jhaiaun, P.; Sukkanon, C.; Chareonviriyaphap, T. Insects. 2023, 14, 155. DOI: https://doi.org/10.3390/insects14020155
60. Pureswaran, D.; Borden, J. Chemoecology. 2004, 14, 67-75. DOI: https://doi.org/10.1007/s00049-003-0260-2
61. Zhao, M.; Liu, B.; Sun, Y.; Wang, Y.; Dai, L.; Chen, H. Pest Manag. Sci. 2020, 76, 188-197. DOI: https://doi.org/10.1002/ps.5492
62. Bhavya, M.; Chandu, A.; Devi, S. Ind. Crops Prod. 2018, 126, 434-439. DOI: https://doi.org/10.1016/j.indcrop.2018.10.043

Downloads
Published
Issue
Section
License
Copyright (c) 2025 Aarón Mendieta-Moctezuma, Luis Mario Ayala-Guerrero, Víctor Eric López y López, Patricia Ibarra-Torres, Petra Andrade-Hoyos, María Berenice González-Maldonado

This work is licensed under a Creative Commons Attribution-NonCommercial 4.0 International License.
Authors who publish with this journal agree to the following terms:
- Authors retain copyright and grant the journal right of first publication with the work simultaneously licensed under a Creative Commons Attribution License that allows others to share the work with an acknowledgement of the work's authorship and initial publication in this journal.
- Authors are able to enter into separate, additional contractual arrangements for the non-exclusive distribution of the journal's published version of the work (e.g., post it to an institutional repository or publish it in a book), with an acknowledgement of its initial publication in this journal.