Fenugreek as a Potential Antiviral Agent against Crimean-Congo Hemorrhagic Fever Virus: an In-depth Theoretical Analysis
Fenugreek as a Potential Antiviral Agent Against Crimean-Congo Hemorrhagic Fever Virus
DOI:
https://doi.org/10.29356/jmcs.v69i4.2384Keywords:
Fever, diosgenin, tigogenone, vicenin, antiviralAbstract
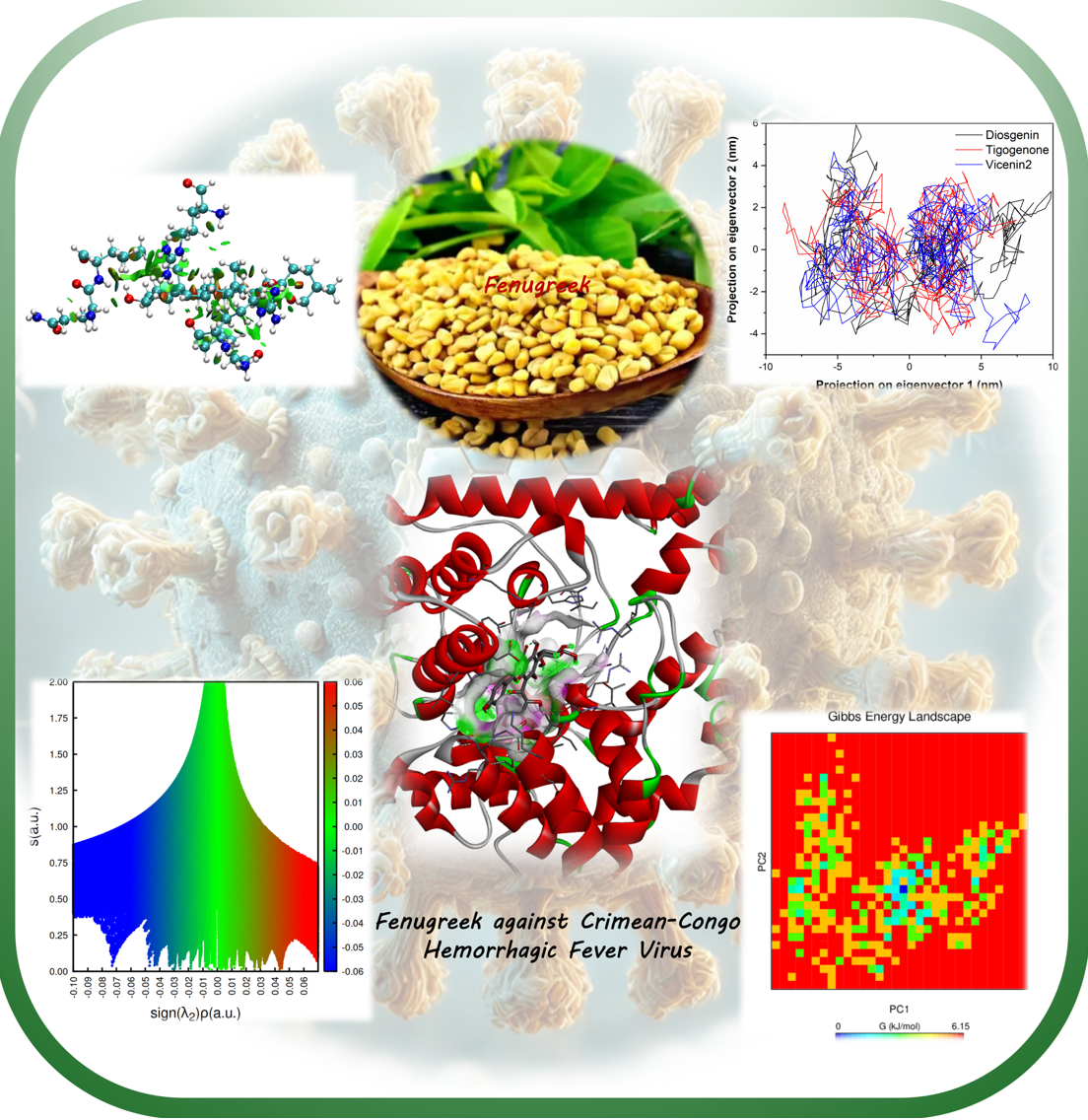
Abstract. Fenugreek is widely known for its important medicinal, nutritional, and culinary applications, offering antipyretic, anti-inflammatory, and antiviral effects. Its antiviral properties make it particularly interesting for addressing viruses like Crimean-Congo Hemorrhagic Fever Virus (CCHFV). Given the lack of approved treatments for CCHFV and the virus's high fatality rate, it demands urgent attention. The nucleoprotein of CCHFV, a critical factor in the virus's replication process, has been identified as a promising target for the development of antiviral therapies. This study aimed to discover inhibitors of this protein through virtual screening. A combination of docking studies and molecular dynamics simulations was employed to screen active compounds from fenugreek for their ability to inhibit the nucleoprotein. Given that CCHFV is classified as a biosafety level-4 pathogen by the World Health Organization (WHO), making it difficult to study in conventional laboratories, in-silico methods provide a safe and efficient alternative for identifying potential inhibitors. Based on the results of molecular docking and dynamic simulations, Diosgenin, Tigogenone, and Vicenin-2 are proposed as potential inhibitors of the CCHFV nucleoprotein. These findings suggest that fenugreek constituents could be promising leads in the development of antiviral therapies for CCHFV.
Resumen. El fenogreco (Trigonella foenum-graecum) es conocido por sus importantes aplicaciones medicinales, nutricionales y culinarias, ofreciendo efectos antipiréticos, antiinflamatorios y antivirales. Estas últimas lo hacen particularmente interesante para enfrentar virus como el de la Fiebre Hemorrágica de Crimea-Congo (CCHFV, por sus siglas en inglés). Dada la ausencia de tratamientos aprobados para el CCHFV y su alta tasa de mortalidad, se requiere una atención urgente. La nucleoproteína del CCHFV, un factor crítico en el proceso de replicación del virus ha sido identificada como un objetivo prometedor para el desarrollo de terapias antivirales. Este estudio tuvo como objetivo descubrir inhibidores de esta proteína mediante cribado virtual. Se empleó una combinación de estudios de acoplamiento molecular y simulaciones de dinámica molecular para evaluar la capacidad de compuestos activos del fenogreco para inhibir la referida nucleoproteína. Dado que el CCHFV está clasificado por la Organización Mundial de la Salud (OMS) como un patógeno de nivel de bioseguridad 4, se dificulta su estudio en laboratorios convencionales, por lo que los métodos in silico ofrecen una alternativa segura y eficiente para la identificación de posibles inhibidores. Con base en los resultados del acoplamiento molecular y las simulaciones dinámicas, se proponen a la diosgenina, la tigogenona y la vicenina-2 como posibles inhibidores de la nucleoproteína del CCHFV. Estos hallazgos sugieren que los componentes del fenogreco podrían constituir candidatos prometedores en el desarrollo de terapias antivirales contra el CCHFV.
Downloads
References
1. Srinivasan, K. Food Rev. Int. 2006 22, 203. DOI: http://dx.doi.org/10.1080/87559120600586315.
2. Al‐Habori, M.; Raman, A., in: Phytotherapy Research: An International Journal Devoted to Pharmacological and Toxicological Evaluation of Natural Product Derivatives. 1998 12, 233
3. Smith, M. Alternative Medicine Review. 2003 8, 20
4. Sun, W.; Shahrajabian, M. H.; Cheng, Q. Mini Rev. Med. Chem. 2021 21, 724. DOI: http://dx.doi.org/10.2174/1389557520666201127104907.
5. Singletary, K. W. Nutr. Today. 2017, 52, 93.
6. Aboubakr, H. A.; Nauertz, A.; Luong, N. T.; Agrawal, S.; El-Sohaimy, S. A.; Youssef, M. M.; Goyal, S. M. J. Food Prot. 2016, 79, 1001. DOI: http://dx.doi.org/10.4315/0362-028X.JFP-15-593.
7. Alu'datt, M. H.; Rababah, T.; Al‐ali, S.; Tranchant, C. C.; Gammoh, S.; Alrosan, M.; Kubow, S.; Tan, T. C.; Ghatasheh, S. J. Food Sci. 2024, 89, 1835
8. Salam, S. G. A.; Rashed, M. M.; Ibrahim, N. A.; Rahim, E. A. A.; Aly, T. A. A.; Al-Farga, A. Sci. Rep. 2023, 13, 7032. DOI: http://dx.doi.org/10.1038/s41598-023-31888-y.
9. Haxhiraj, M.; White, K.; Terry, C. Int. J. Mol. Sci. 2024, 25, 6987. DOI: http://dx.doi.org/10.3390/ijms25136987.
10. Agrawal, S.; Sanap, S. N.; Bisen, A. C.; Biswas, A.; Choudhury, A. D.; Verma, S. K.; Jaiswal, S.; Narender, T.; Bhatta, R. S. Bioanalysis. 2023, 15, 711. DOI: http://dx.doi.org/10.4155/bio-2023-0074.
11. Ahmad, I.; Kuznetsov, A. E.; Pirzada, A. S.; Alsharif, K. F.; Daglia, M.; Khan, H. Front. Chem. 2023, 11, 1145974. DOI: http://dx.doi.org/10.3389/fchem.2023.1145974.
12. Konstantinidis, N.; Franke, H.; Schwarz, S.; Lachenmeier, D. W. Molecules. 2023, 28, 3460. DOI: http://dx.doi.org/10.3390/molecules28083460.
13. Arya, P.; Munshi, M.; Kumar, P. Food Chemistry Advances. 2023, 2, 100170.
14. Aghababaei, F.; Hadidi, M. Pharmaceuticals. 2023, 16, 1020. DOI: http://dx.doi.org/10.3390/ph16071020.
15. Whitehouse, C. A. Antiviral Res. 2004, 64, 145. DOI: http://dx.doi.org/10.1016/j.antiviral.2004.08.001.
16. Elaldi, N.; and Kaya, S. J. Med. Microbiol. Infect. Dis. 2014, 4, 1.
17. Swanepoel, R.; Gill, D. E.; Shepherd, A. J.; Leman, P. A.; Mynhardt, J. H.; Harvey, S. Rev. Infect. Dis. 1989, 11, Suppl 4, S794. DOI: http://dx.doi.org/10.1093/clinids/11.supplement_4.s794.
18. Deyde, V. M.; Khristova, M. L.; Rollin, P. E.; Ksiazek, T. G.; Nichol, S. T. J. Virol. 2006, 80, 8834. DOI: http://dx.doi.org/10.1128/JVI.00752-06.
19. Kumar Panja, S.; Kumar, S.; Fazal, A. D.; Bera, S. J. Photochem. Photobiol. A Chem. 2023, 445, 115084. DOI: http://dx.doi.org/10.1016/j.jphotochem.2023.115084.
20. Kumar Panja, S.; and Kumar, S. J. Mol. Liq. 2023, 375, 121354. DOI: http://dx.doi.org/10.1016/j.molliq.2023.121354.
21. Kumar, S.; Prajapat, A.; Panja, S. K.; Shukla, M., in: Green Chemical Synthesis with Microwaves and Ultrasound. 2024, 1.
22. Kumar Sada, P.; Kaur Jassal, A.; Bar, A.; Kumar, P.; Srikrishna, S.; Kumar, S.; Kumar Singh, A.; Lee, Y.; Singh, L.; Rai, A. Microchem. J. 2024, 207, 111710. DOI: http://dx.doi.org/10.1016/j.microc.2024.111710.
23. Panja, S. K.; Kumar, S.; Haddad, B.; Patel, A. R.; Villemin, D.; Amine, H.-M.; Bera, S.; Debdab, M. Physchem. 2024, 4, 369. DOI: http://dx.doi.org/10.3390/physchem4040026.
24. Srivastava, S.; Kumar, S.; Sharma, P. K.; Rustagi, S.; Mohanty, A.; Donovan, S.; Henao-Martinez, A. F.; Sah, R.; Franco-Paredes, C. Health Sci. Rep. 2024, 7, e70053. DOI: http://dx.doi.org/10.1002/hsr2.70053.
25. Kiefer, F.; Arnold, K.; Kunzli, M.; Bordoli, L.; Schwede, T. Nucleic Acids Res. 2009 37, D387. DOI: http://dx.doi.org/10.1093/nar/gkn750.
26. Waterhouse, A.; Bertoni, M.; Bienert, S.; Studer, G.; Tauriello, G.; Gumienny, R.; Heer, F. T.; de Beer, T. A. P.; Rempfer, C.; Bordoli, L.; Lepore, R.; Schwede, T. Nucleic Acids Res. 2018, 46, W296. DOI: http://dx.doi.org/10.1093/nar/gky427.
27. Madeira, F.; Madhusoodanan, N.; Lee, J.; Eusebi, A.; Niewielska, A.; Tivey, A. R. N.; Lopez, R.; Butcher, S. Nucleic Acids Res. 2024, 52, W521. DOI: http://dx.doi.org/10.1093/nar/gkae241.
28. Muhamad, F.; Ahmad, R. B.; Asi, S.; Murad, M. N. J. Phys. Conf. Ser. 2018, 1019, 012085.
29. Kumar, S., J. Serb. Chem. Soc. 2023 88, 381 DOI: http://dx.doi.org/10.2298/jsc220921087k.
30. Kumar, S.; and Panja, S. K. Theor. Chem. Acc. 2023, 142, 126. DOI: http://dx.doi.org/10.1007/s00214-023-03073-x.
31. Trott, O.; and Olson, A. J. J. Comput. Chem. 2010, 31, 455. DOI: http://dx.doi.org/10.1002/jcc.21334.
32. Berendsen, H. J.; van der Spoel, D.; van Drunen, R. Comput. Phys. Commun. 1995, 91, 43.
33. Mark, P.; and Nilsson, L. J. Phys. Chem. A. 2001, 105, 9954.
34. Kumar, V.; Kumar, R.; Kumar, N.; Kumar, S. Asian J. Chem. 2023, 35, 991. DOI: http://dx.doi.org/10.14233/ajchem.2023.27594.
35. Ergonul, O. Curr. Opin. Virol. 2012, 2, 215. DOI: http://dx.doi.org/10.1016/j.coviro.2012.03.001.
36. Frank, M. G.; Weaver, G.; Raabe, V. Emerg. Infect. Dis. 2024, 30, 847. DOI: http://dx.doi.org/10.3201/eid3005.231646.
37. Tewari, A.; Singh, R.; Brar, J. K. J. Phytopharm. 2024, 13, 97. DOI: http://dx.doi.org/10.1016/j.sajb.2022.04.014.
38. Contreras-Garcia, J.; Johnson, E. R.; Keinan, S.; Chaudret, R.; Piquemal, J. P.; Beratan, D. N.; Yang, W. J. Chem. Theory Comput. 2011, 7, 625. DOI: http://dx.doi.org/10.1021/ct100641a.

Downloads
Additional Files
Published
Issue
Section
License
Copyright (c) 2025 Sumit Kumar, Ravindra Kumar, Nagendra Kumar

This work is licensed under a Creative Commons Attribution-NonCommercial 4.0 International License.
Authors who publish with this journal agree to the following terms:
- Authors retain copyright and grant the journal right of first publication with the work simultaneously licensed under a Creative Commons Attribution License that allows others to share the work with an acknowledgement of the work's authorship and initial publication in this journal.
- Authors are able to enter into separate, additional contractual arrangements for the non-exclusive distribution of the journal's published version of the work (e.g., post it to an institutional repository or publish it in a book), with an acknowledgement of its initial publication in this journal.









