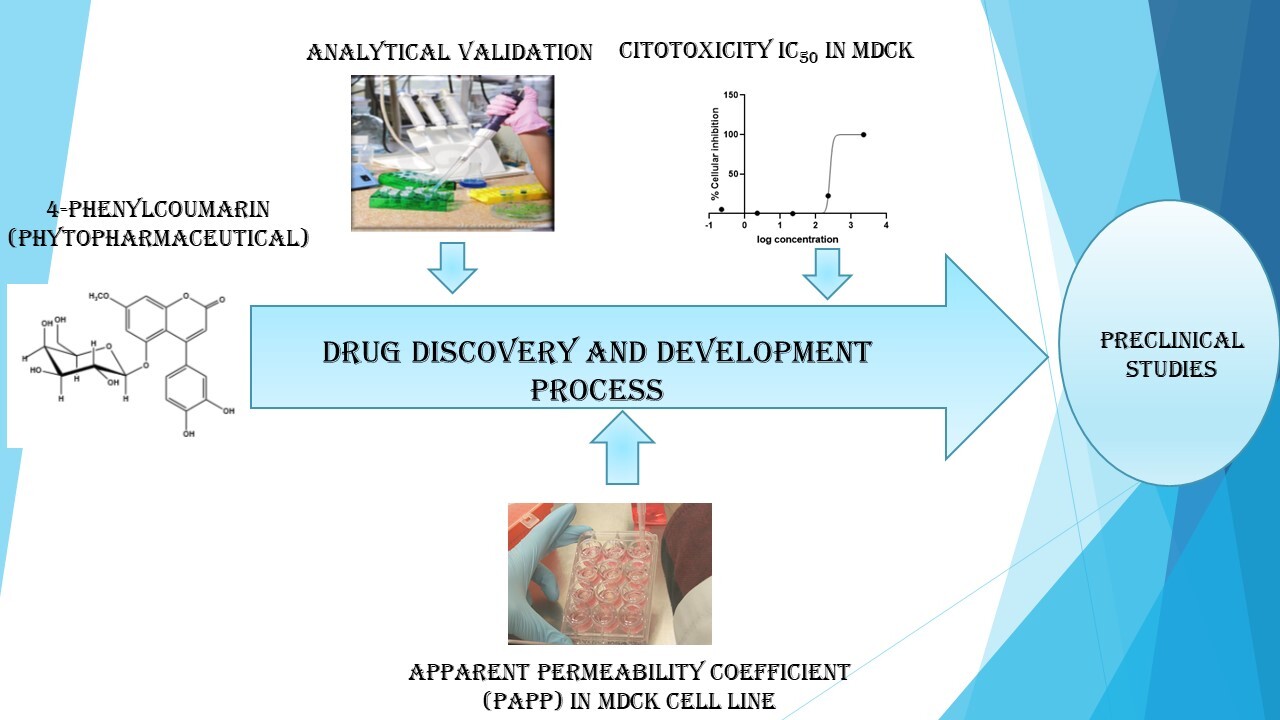
Evaluation of the Apparent Permeability Xoefficient (Papp) of 5-o-β-d galactopyranosyl-7-methoxy-3'-4'-dihydroxy-4-phenylcoumarin in MDCK Cells
DOI:
https://doi.org/10.29356/jmcs.v69i3.2330Keywords:
Cytotoxicity, permeability, 5-o-β-d galactopyranosyl-7-methoxy-3'-4'-dihydroxy-4-phenylcoumarin, MDCK, Hintonia latifloraAbstract
Abstract. Diabetes mellitus is a common chronic degenerative disease around the world. With the Encuesta Nacional de Salud y Nutrición (ENSANUT or National Health and Nutrition Survey) ranking the disease among the highest in terms of morbidity in Mexico[1], allied to the increase in metabolic syndrome worldwide, the development of new medicines for the treatment of diabetes mellitus is essential. Among these medicines is 5-O-β-D-galactopyranosyl-7-methoxy-3’-4’-dihydroxy-4-phenylcoumarin, an organic compound isolated from the leaves of Hintonia latiflora, also known as copalchi [2,3]. An effective preclinical assessment of a drug candidate molecule requires various preclinical tests, including the measurement of apparent permeability in in vitro models. [4-7] Using HPLC-UV, an analytical method was developed and then validated by means of both the FDA validation guidelines for bioanalytical methods (2001) and NOM-177-SSA1-2013 [8,9], with the method found to be reproducible, sensitive, and selective for the determination of 5-O-β-D-galactopyranosyl-7-methoxy-3',4'-dihydroxy-4-phenylcoumarin, which is a phytodrug (4-FC) corresponding to the Madin-Darby canine kidney (MDCK) cell line. The cytotoxicity of the phytodrug was determined for concentrations ranging from 0.1 to 100 μg/mL, [10] using cis-platinum as a positive control (0.01 to 10 μg/mL). The results obtained showed a non-significant cytotoxic effect in a range of 0.10 to 100 µg/mL, while, at concentrations of 4, 8 and, 16 μg/mL, the phytodrug presented a permeation rate (dQ/dt) higher than ranitidine hydrochloride (Ran) and lower than propranolol hydrochloride (Pro), thus suggesting a moderate permeation rate. The present study developed and validated a method for quantifying the analyte of interest, with cytotoxicity (IC50) and permeability tests also carried out in MDCK cells.
Resumen. La diabetes mellitus es una enfermedad crónico degenerativa común a nivel mundial. En México, la ENSANUT reporta que dicha enfermedad ocupa primeros lugares de morbilidad. [1] El aumento del síndrome metabólico a nivel mundial, hace indispensable el desarrollo de nuevos medicamentos para tratar la diabetes mellitus, tal es el caso de la 5-O-β-D-galactopiranosil-7-metoxi-3’-4’-dihidroxi-4-fenilcumarina; un compuesto orgánico aislado de las hojas de Hintonia latiflora conocida como “Copalchi” [2,3]. Para una adecuada evaluación a nivel preclínico de moléculas candidatas a fármaco es necesario realizar diversas pruebas a nivel preclínico, entre ellas la permeabilidad aparente en modelos in vitro. [4-7] Se desarrollo y se realizó la validación de un método analítico por HPLC-UV, considerando las guías de validación de Métodos Bioanalíticos por la FDA (2001) y la NOM-177-SSA1-2013. [8,9], el mmétodo resultóser reproducible, sensible y selectivo para la determinación de la 5-O- β-D-galactopiranosil-7-metoxi-3',4'-dihidroxi-4-fenilcumarina un fitofármaco (4-FC) en la línea celular epitelio de riñón canino Madin-Darby (MDCK). Se determinó la citotoxicidad del fitofármaco en un rango de concentraciones de 0.1 a 100 μg/mL, [10] utilizando cis-platino como control positivo (0.01 a 10 μg/mL). Los resultados mostraron un efecto citotóxico no significativo en un rango de 0.10 a 100 µg/mL del fitofármaco a las concentraciones 4, 8 y 16 μg/mL, presentó una velocidad de permeación (dQ/dt) mayor que el clorhidrato de ranitidina (Ran) y menor que el clorhidrato de propranolol (Pro); lo que sugiere una velocidad de permeación moderada para dicho fitofármaco. En este trabajo se desarrollo, se validó el método para la cuantificación del analito de interés, se hizo el estudio de citotoxicidad (IC50) y el estudio de permeabilidad en células MDCK.
Downloads
References
https://ensanut.insp.mx/encuestas/ensanutcontinua2022/index.php, accessed in January 2022.
Cristians, S., in: Investigación farmacológica y química de las hojas de Hintonia latiflora (Sessé et Mociño ex DC.) Bullock (Rubiaceae): Una contribución para la elaboración de su monografía tipo OMS. MSc Thesis, Universidad Nacional Autónoma de México, Postgraduate in Biological Sciences, C.U. 2009.
Cristians, S., in: Parámetros de calidad, seguridad y eficacia de las infusiones de hojas y corteza de Hintonia latiflora (Sessé et Mociño ex DC.) Bullock y H. standleyana Bullock (Rubiaceae): un enfoque al desarrollo de preparados fititerapéuticos. PhD Thesis, Universidad Nacional Autónoma de México, Postgraduate in Biological Sciences, C.U. 2013.
Avdeef, A., in: Absorption and Drug Development: Solubility, Permeability, and Charge State. PRESS USA Wiley-Interscience, USA, 2003, 1-287. DOI: https://doi.org/10.1002/047145026X
Balimane, P.V.; Chong, S.; Morrison, R.A. J. Pharm. Toxicol. Met. 2000, 44, 301-312. DOI: http://dx.doi.org/10.1016/s1056-8719(00)00113-1. DOI: https://doi.org/10.1016/S1056-8719(00)00113-1
Barthelson, R. A.; Sundareshan, P.; Galbraith, D. W.; Woosley, R. L. D. Amer. J. Bot. 2006, 93, 566–574. DOI: https://doi.org/10.3732/ajb.93.4.566.
Becker, W., Kleinsmith, L.; Hardin, J., in: El mundo de la célula, 6a edition, Madrid: Pearson Educación Press, Madrid, 2007, 1-830.
https://www.fda.gov/regulatory-information/search-fda-guidancedocuments/statistical-approaches-establishing-bioequivalence, accessed in June 2001.
https://www.dof.gob.mx/nota_detalle.php?codigo=5314833&fecha=20/09/2013#gsc.tab=0, accessed in June 2022.
Skehan, P.; Storeng, R.; Scudiero, D.; Monks, A.; McMahon, J.; Vistica, D.; Warren, J.T.; Bokesch, H.; Kenney, S.; Boyd, M.R. J. Natl. Cancer Inst. 1990, 82, 1107-1112. DOI: 10.1093/jnci/82.13.1107. DOI: https://doi.org/10.1093/jnci/82.13.1107
Puig-Domingo, M.; De Leiva Hidalgo, A., in: Endocrinología clínica, Vol 14, Ed. Díaz de Santos Press, España,1995,14, 241-249.
https://www.idf.org/diabetesatlas, accessed June 2013.
Emily B. Schroeder, M.D., in: National Library of Medicine, Ed., Endotext [Internet]. South Dartmouth (MA): MDText.com, Inc., PMID: 28402618, 2022, 2000. Available from: https://www.ncbi.nlm.nih.gov/books/NBK425702/.
Cristians, S.; Gurerrero-Analco, J. A.; Pérez-Vásquez, A.; Palacios-Espinosa, F.; Ciangherotti, C.; Bye, R.; Mata, R. J. Nat. Prod.2007,72, 408-413. DOI: https://doi.org/10.1021/np800642d.
Guerrero-Analco, J. A.; Medina-Campos, O.; Brindis, F.; Bye, R.; Pedraza- Chaverri, J.; Navarrete, A.; Mata, R.; Phytochem. 2007, 68, 2087-2095. DOI: https://doi.org/10.1016/j.phytochem.2007.05.006.
Escobar, L.; Alfonso, P.A.; Aristizábal, F.A. Rev.Colomb. Biotecnol. 2009, XI, 49-56.
Braun, A.; Hammerle, S.; Suda, K.; Rothen-Rutishauser, B.; Gunthert, M.; Kramer, S.; Wunderli-Allenspach, H. Eur. J. Pharm. Sci. 2000, 11, S51–S60, DOI: https://doi.org/10.1016/S0928-0987(00)00164-0.
Rajasekhar P.; Praveen K. V., in: Animal Cell Culture and Technology, Scholars Press, USA, 2019, 1-440.
Irvine, D.J.; Kakahashi, L.; Lockhart, K.; Cheong, J.; Tolan, J.W.; Selick, H.E. J. Pharm. Sci. 1999, 88, 28-33. DOI: https://doi.org/110.1021/js9803205. DOI: https://doi.org/10.1021/js9803205
Iftekhar, A.; Leach, D. N.; Wohlmuth, H.; De Voss, J. J.; Blanchfield, J.T. ACS Publications. 2020, 5, 21561-21569. DOI: https://doi.org/10.1021/acsomega.0c02180.
Dahan, A.; Miller, J.M.; Amidon, G. The AAPS J. 2009, 11, 740-746. DOI: https://doi.org/10.1208/s12248-009-9144-x.
Estrada, L., in: Efecto limitante de la glicoproteína-P como transportador intestinal de eflujo en la absorción oral y biodisponibilidad de fármacos. DegreeThesis, Universidad Nacional Autónoma de México, Chemistry Faculty, C.U. 2014.
Yazdanian, M.; Briggs, K.; Jankovsky, C.; Hawi, A.; Pharm. Res. 2004, 21, 293-299. DOI: https://doi.org/10.1023/B:PHAM.0000016242.48642.71.
Kerns, E.H.; Di, L., in: Drug-like Properties: Concepts, Structure Design and Methods: from ADME to Toxicity Optimization, Ed., Academic Press, Elsevier, ISBN: 9780080557618, USA, 2008, 90-123.
Amidon, G.L.; Lennernäs, H.; Shah, V.P.; Crison, J.R. Pharm. Res. 1995, 12, 413-420. DOI: https://doi.org/10.1023/A:1016212804288.
Artursson, P.; Karlsson, J. Biochem. Biophys. Res. Commun. 1991, 175, 880-885, DOI: https://doi.org/10.1016/0006-291X(91)91647-U.
Artursson, P. J. Pharm. Sci. 1990, 79, 476-482. DOI: https://doi.org/10.1002/jps.2600790604.
Armijo, J. A. in: Absorción, distribución y eliminación de los fármacos, Farmacología Humana. Ed., Masson S.A. Press, España,1997, 47-72.

Downloads
Published
Issue
Section
License
Copyright (c) 2025 Nancy Vara Gama, Kenneth Rubio Carrasco, Vanessa González Covarrubias, Sol Cristians Niizawa, Ines Fuentes Noriega

This work is licensed under a Creative Commons Attribution-NonCommercial 4.0 International License.
Authors who publish with this journal agree to the following terms:
- Authors retain copyright and grant the journal right of first publication with the work simultaneously licensed under a Creative Commons Attribution License that allows others to share the work with an acknowledgement of the work's authorship and initial publication in this journal.
- Authors are able to enter into separate, additional contractual arrangements for the non-exclusive distribution of the journal's published version of the work (e.g., post it to an institutional repository or publish it in a book), with an acknowledgement of its initial publication in this journal.