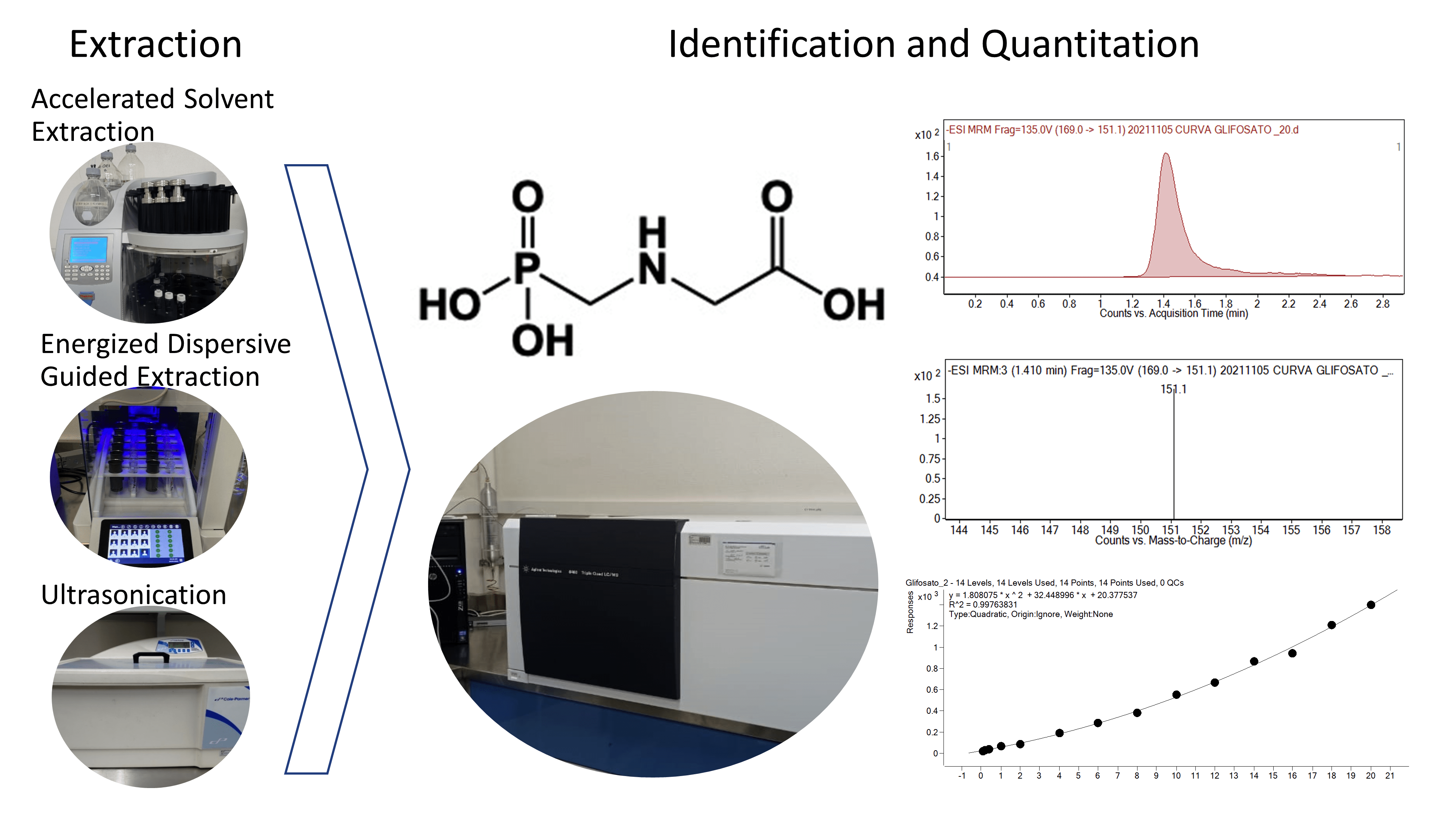
Comparative Evaluation of Different Extraction Methods for Identification and Quantification of Glyphosate in Fortified Corn Flour
DOI:
https://doi.org/10.29356/jmcs.v67i3.1945Keywords:
Glyphosate-2-13C quantification, herbicide extraction, corn flour, liquid chromatography coupled to mass spectrometryAbstract
Abstract. Glyphosate is one of the most widely used herbicides around the world. Over the past decade, the use of glyphosate and related molecules has significantly risen despite its suggested harmful effects on human health. Therefore, it is of great interest to establish reliable and scalable extraction and quantification pipelines for glyphosate in food-associated products. This herbicide is difficult to detect in foods and related matrices because of its chemical features. In this work, we tested different concentrations of solvents and various extraction protocols for recovering this pesticide. For quantification, we used a dynamic multiple reaction monitoring (dMRM) method in an ultra-high resolution liquid chromatograph coupled to a triple quadrupole mass spectrometer (UPLC-MS-QqQ). We determined that 20 % (v/v) methanol in water was the best solvent for extraction. Accelerated solvent extraction (ASE) and ultrasonication approach allowed better recovery values. However, extraction with the energized dispersive extraction system (EDGE) exhibited a more efficient result in half of the time compared to the other automated protocol tested in our study. Our investigation provides valuable information for the extraction, identification, and quantification of glyphosate-2-13C, which will contribute to monitoring the level of this herbicide in corn flour.
Resumen. El glifosato es uno de los herbicidas más utilizados en todo el mundo. Durante la última década, el uso del glifosato y las moléculas derivadas de este compuesto ha aumentado significativamente a pesar de los efectos nocivos que se han indicado para la salud humana. Por lo tanto, es de gran interés establecer herramientas de extracción y cuantificación confiables y escalables para glifosato en los productos asociados con alimentos. Este plaguicida es difícil de detectar en alimentos y otras matrices afines debido a sus características químicas. En este estudio probamos diferentes concentraciones de solventes y varios protocolos de extracción para la recuperación de este herbicida. Para la cuantificación utilizamos un método de monitoreo dinámico de múltiples reacciones (dMRM) en un cromatógrafo de líquidos de ultra alta resolución acoplado a un espectrómetro de masas de triple cuadrupolo (UPLC-MS-QqQ). Determinamos que 20 % (v/v) de metanol en agua era el mejor solvente para la extracción. Las herramientas de extracción acelerada por solventes (ASE) y ultrasonicación permitieron los mejores valores de recuperación. Sin embargo, la extracción con el sistema de extracción dispersiva energizada (EDGE) mostró resultados eficientes en la mitad del tiempo, en comparación con el otro protocolo automatizado probado en nuestro estudio. Nuestra investigación provee información valiosa para la extracción y cuantificación de glifosato-2-13C, lo que contribuirá a monitorear niveles de este herbicida en harina de maíz.
Downloads
References
Razzaq, A.; Wani, S. H.; Saleem, F.; Yu, M.; Zhou, M.; Shabala, S. J. Exp. Bot. 2021, 72, 6123–6139. DOI:10.1093/JXB/ERAB276. DOI: https://doi.org/10.1093/jxb/erab276
Laing, R.; Gillan, V.; Devaney, E. Trends Parasitol. 2017, 33, 463–472. DOI: https://doi.org/10.1016/j.pt.2017.02.004
Meftaul, I. M.; Venkateswarlu, K.; Dharmarajan, R.; Annamalai, P.; Asaduzzaman, M.; Parven, A.; Megharaj, M. Environ. Pollut. 2020, 263, 114372. DOI:10.1016/J.ENVPOL.2020.114372. DOI: https://doi.org/10.1016/j.envpol.2020.114372
Zoller, O.; Rhyn, P.; Zarn, J. A.; Dudler, V. Int. J. Hyg. Environ. Health. 2020, 228, 113526. DOI: https://doi.org/10.1016/j.ijheh.2020.113526
Woźniak, E.; Reszka, E.; Jabłońska, E.; Mokra, K.; Balcerczyk, A.; Huras, B.; Zakrzewski, J.; Bukowska, B. Toxicology In Vitro. 2020, 66, 104878. DOI: https://doi.org/10.1016/j.tiv.2020.104878
Tan, S.; Li, G.; Liu, Z.; Wang, H.; Guo, X.; Xu, B. Environ. Toxicol. Pharmacol. 2022, 90, 103792. DOI: https://doi.org/10.1016/j.etap.2021.103792
Baek, Y.; Bobadilla, L. K.; Giacomini, D. A.; Montgomery, J.S.; Murphy, B.P.; Tranel, P.J. Pest. Manag. Sci. 2021, 255, 93–128. DOI: https://doi.org/10.1007/398_2020_55
Benbrook, C. M. Environ. Sci. Eur. 2012, 24, 1–13. DOI: https://doi.org/10.1186/2190-4715-24-24
Williams, G. M.; Kroes, R.; Munro, I. C. Regul. Toxicol. Pharmacol. 2000, 31, 117–165. DOI: https://doi.org/10.1006/rtph.1999.1371
Duke, S.O. Pest. Manag. Sci. 2018, 74, 1027–1034. DOI: https://doi.org/10.1002/ps.4652
Zulet-González, A.; Barco-Antoñanzas, M.; Gil-Monreal, M.; Royuela, M.; Zabalza, A. Front. Plant. Sci. 2020, 11, 459. DOI: https://doi.org/10.3389/fpls.2020.00459
Heap, I.; Duke, S. O. Pest. Manag. Sci. 2018, 74, 1040–1049. DOI: https://doi.org/10.1002/ps.4760
Franke, A. A.; Li, X.; Shvetsov, Y. B.; Lai, J. F. Environ. Pollut. 2021, 277, 116848. DOI: https://doi.org/10.1016/j.envpol.2021.116848
de Araújo-Ramos, A. T.; Passoni, M. T.; Romano, M. A.; Romano, R. M.; Martino-Andrade, A. J. Front. Endocrinol. 2021, 12, 160. DOI: https://doi.org/10.3389/fendo.2021.627210
Coullery, R. P.; Ferrari, M. E.; Rosso, S. B. Neurotoxicology. 2016, 52, 150–161. DOI: https://doi.org/10.1016/j.neuro.2015.12.004
Hashimoto, K.; Hammock, B. D. Proc. Natl. Acad. Sci. USA. 2021, 118. DOI: https://doi.org/10.1073/pnas.2016496118
Andreotti, G.; Koutros, S.; Hofmann, J. N.; Sandler, D. P.; Lubin, J. H.; Lynch, C. F.; Lerro, C. C.; De Roos, A. J.; Parks, C. G.; Alavanja, M. C.; et al. J. Natl. Cancer Inst. 2018, 110, 509–516. DOI: https://doi.org/10.1093/jnci/djx233
Chiesa, L. M.; Nobile, M.; Panseri, S.; Arioli, F. Food Addit. Contam. Part A Chem. Anal. Control Expo. Risk Assess. 2019, 36, 592–600. DOI: https://doi.org/10.1080/19440049.2019.1583380
Chen, M. X.; Cao, Z. Y.; Jiang, Y.; Zhu, Z. W. J. Chromatogr. A. 2013, 1272, 90–99. DOI:10.1016/j.chroma.2012.11.069. DOI: https://doi.org/10.1016/j.chroma.2012.11.069
Botero-Coy, A. M.; Ibáñez, M.; Sancho, J. V.; Hernández, F. J. Chromatogr. A. 2013, 1313, 157–165. DOI:10.1016/j.chroma.2013.07.037. DOI: https://doi.org/10.1016/j.chroma.2013.07.037
Alferness, P. L.; Wiebe, L. A. J. AOAC Int. 2001, 84, 823–846. DOI: https://doi.org/10.1093/jaoac/84.3.823
Manzano-Sánchez, L.; Martínez-Martínez, J. A.; Domínguez, I.; Vidal, J. L. M.; Frenich, A. G.; Romero-González, R. Foods. 2020, 9. DOI:10.3390/foods9050553. DOI: https://doi.org/10.3390/foods9050553
Hanke, I.; Singer, H.; Hollender, J. Anal. Bioanal. Chem. 2008, 391, 2265–2276. DOI:10.1007/s00216-008-2134-5. DOI: https://doi.org/10.1007/s00216-008-2134-5
Ibáñez, M.; Pozo, Ó. J.; Sancho, J. V.; López, F. J.; Hernández, F. J. Chromatogr. A. 2005, 1081, 145–155, DOI:10.1016/j.chroma.2005.05.041. DOI: https://doi.org/10.1016/j.chroma.2005.05.041
Kaczyński, P.; Łozowicka, B. Open Chem. 2015, 13, 1011–1019. DOI:10.1515/chem-2015-0107. DOI: https://doi.org/10.1515/chem-2015-0107
Paravani, E. V.; Sasal, M. C.; Sione, S. M. J.; Gabioud, E. A.; Oszust, J. D.; Wilson, M. G.; Demonte, L. D.; Repetti, M. R. Rev. Int. Contam. Ambiental. 2016, 32, 399–406. DOI:10.20937/RICA.2016.32.04.03. DOI: https://doi.org/10.20937/RICA.2016.32.04.03
Druart, C.; Delhomme, O.; De Vaufleury, A.; Ntcho, E.; Millet, M. Anal Bioanal Chem 2011, 399, 1725–1732, doi:10.1007/s00216-010-4468-z. DOI: https://doi.org/10.1007/s00216-010-4468-z
Khrolenko, M. V.; Wieczorek, P. P. J. Chromatogr. A. 2005, 1093, 111–117. DOI:10.1016/j.chroma.2005.07.062. DOI: https://doi.org/10.1016/j.chroma.2005.07.062
Li, X.; Xu, J.; Jiang, Y.; Chen, L.; Xu, Y.; Pan, C. Acta Chromatogr. 2009, 21, 559–576. DOI:10.1556/AChrom.21.2009.4.4. DOI: https://doi.org/10.1556/AChrom.21.2009.4.4
Matozzo, V.; Fabrello, J.; Marin, M. G. J. Mar. Sci. Eng. 2020, 8. DOI:10.3390/JMSE8060399. DOI: https://doi.org/10.3390/jmse8060399
Gill, J. P. K.; Sethi, N.; Mohan, A. Environ. Chem. Lett. 2017, 15, 85–100. DOI: https://doi.org/10.1007/s10311-016-0585-z
Jansons, M.; Pugajeva, I.; Bartkevics, V.; Karkee, H. B. J. Chromatogr. B Analyt. Technol. Biomed. Life Sci. 2021, 1177. DOI:10.1016/j.jchromb.2021.122779. DOI: https://doi.org/10.1016/j.jchromb.2021.122779
Bressán, I. G.; Llesuy, S. F.; Rodriguez, C.; Ferloni, A.; Dawidowski, A. R.; Figar, S. B.; Giménez, M. I. J. Chromatogr. B Analyt. Technol. Biomed. Life Sci. 2021, 1171. DOI:10.1016/j.jchromb.2021.122616. DOI: https://doi.org/10.1016/j.jchromb.2021.122616
Babic, S.; Ivanković, A.; Macan, J.; Aštelan-macan, M. Agriculturae Conspectus Scientificus. 2005, 70, 99–103.
Gębura, K.; Wieczorek, P. P.; Poliwoda, A. Membranes (Basel). 2022, 12, DOI:10.3390/membranes12010020. DOI: https://doi.org/10.3390/membranes12010020
Rodriguez-Gil, J. L.; Lissemore, L.; Solomon, K.; Hanson, M. Sci. Total Environ. 2016, 550, 449–458. DOI:10.1016/j.scitotenv.2016.01.140. DOI: https://doi.org/10.1016/j.scitotenv.2016.01.140
Knaak, J. B. Reviews of Environmental Contamination and Toxicology Glyphosate; 1st ed.; Springer, 2021; Vol. 255; ISBN 978-3-030-68482-2. DOI: https://doi.org/10.1007/978-3-030-68483-9
Koskinen, W. C.; Marek, L. J.; Hall, K. E. Pest. Manag. Sci. 2016, 72, 423–432. DOI:10.1002/ps.4172. DOI: https://doi.org/10.1002/ps.4172
Wilkowska, A.; Biziuk, M. Food Chem. 2011, 125, 803–812. DOI:10.1016/j.foodchem.2010.09.094. DOI: https://doi.org/10.1016/j.foodchem.2010.09.094
Farajzadeh, M. A.; Abbaspour, M.; Kazemian, R.; Afshar Mogaddam, M. R. J. Sci. Food Agric. 2020, 100, 1904–1912. DOI:10.1002/jsfa.10200. DOI: https://doi.org/10.1002/jsfa.10200
Farajzadeh, M. A.; Mohebbi, A.; Fouladvand, H.; Mogaddam, M. R. A. Microchem. J. 2020, 155. DOI:10.1016/j.microc.2020.104795. DOI: https://doi.org/10.1016/j.microc.2020.104795
Pastor, S. J.; Castoro, J. A.; Wilkins, C. L. High-Mass Analysis Using Quadrupolar Excitation/ Ion Cooling in a Fourier Transform Mass Spectrometer; 1995; Vol. 67. DOI: https://doi.org/10.1021/ac00098a024
Schwartz, J. C.; Senko, M. W.; Syka, J. E. P. Focus: quadrupole ion traps a Two-Dimensional Quadrupole Ion Trap Mass Spectrometer; 2002. DOI: https://doi.org/10.1016/S1044-0305(02)00384-7
Murray, K. K.; Boyd, R. K.; Eberlin, M. N.; John Langley, G.; Li, L.; Naito, Y. Pure Appl. Chem. 2013, 85, 1515–1609. DOI: 10.1351/PAC-REC-06-04-06. DOI: https://doi.org/10.1351/PAC-REC-06-04-06
https://cem.com/, accessed in October 2022.
Cole-Parmer, https://www.coleparmer.com/i/cole-parmer-20-liter-ultrasonic-cleaner-with-digital-timer-and-heat-230-vac/0889574, accessed in November 2022.
Thermo Scientific Dionex ASE 350 Accelerated Solvent Extractor Operator’s Manual. 2011; Vol. 065220.
Santilio, A.; Pompili, C.; Giambenedetti, A. J. Environ. Sci. Health B. 2019, 54, 205–210, DOI:10.1080/03601234.2018.1550306. DOI: https://doi.org/10.1080/03601234.2018.1550306
Chamkasem, N.; Harmon, T. Anal. Bioanal. Chem. 2016, 408, 4995–5004. DOI:10.1007/s00216-016-9597-6. DOI: https://doi.org/10.1007/s00216-016-9597-6
Trujillo, F. J.; Vélez, A.; Zamora, M. C.; Cedillo, J. G.; et al., SENASICA, 2022.
Gimsing, A. L.; Borggaard, O. K.; Jacobsen, O. S.; Aamand, J.; Sørensen, J. Appl. Soil Ecol. 2004, 27, 233–242. DOI:10.1016/j.apsoil.2004.05.007. DOI: https://doi.org/10.1016/j.apsoil.2004.05.007
Pesticide Detail | CODEXALIMENTARIUS FAO-WHO Available online: https://www.fao.org/fao-who-codexalimentarius/codex-texts/dbs/pestres/pesticide-detail/en/?p_id=158, accessed on 22 March 2023.
Martins-Júnior, H. A.; Lebre, D. T.; Wang, A. Y.; Pires, M. A. F.; Bustillos, O. V. Rapid Commun. Mass Spectrom. 2009, 23, 1029–1034. DOI:10.1002/rcm.3960. DOI: https://doi.org/10.1002/rcm.3960
Nagatomi, Y.; Yoshioka, T.; Yanagisawa, M.; Uyama, A.; Mochizuki, N. Biosci. Biotechnol. Biochem. 2013, 77, 2218–2221. DOI:10.1271/bbb.130433. DOI: https://doi.org/10.1271/bbb.130433
https://www.eurl-pesticides.eu, accessed in November 2022.
https://www.epa.gov/pesticide-registration/pesticide-registration-manual-chapter-6-amending-registered-pesticide, accessed in November 2022.
Rosales, E.; Ricardo, R.; de La Cruz, S. INIFAP 2006, 1–39.
Granby, K.; Johannesen, S.; Vahl, M. Food Addit. Contam. 2003, 20, 692–698. DOI:10.1080/0265203031000109477. DOI: https://doi.org/10.1080/0265203031000109477

Downloads
Published
Issue
Section
License
Copyright (c) 2023 Liliana Hortencia Méndez-Barredo, Juan Luis Monribot-Villanueva, Esaú Bojórquez-Velázquez, José Miguel Elizalde-Contreras, José Antonio Guerrero-Analco, Eliel Ruiz-May

This work is licensed under a Creative Commons Attribution-NonCommercial 4.0 International License.
Authors who publish with this journal agree to the following terms:
- Authors retain copyright and grant the journal right of first publication with the work simultaneously licensed under a Creative Commons Attribution License that allows others to share the work with an acknowledgement of the work's authorship and initial publication in this journal.
- Authors are able to enter into separate, additional contractual arrangements for the non-exclusive distribution of the journal's published version of the work (e.g., post it to an institutional repository or publish it in a book), with an acknowledgement of its initial publication in this journal.