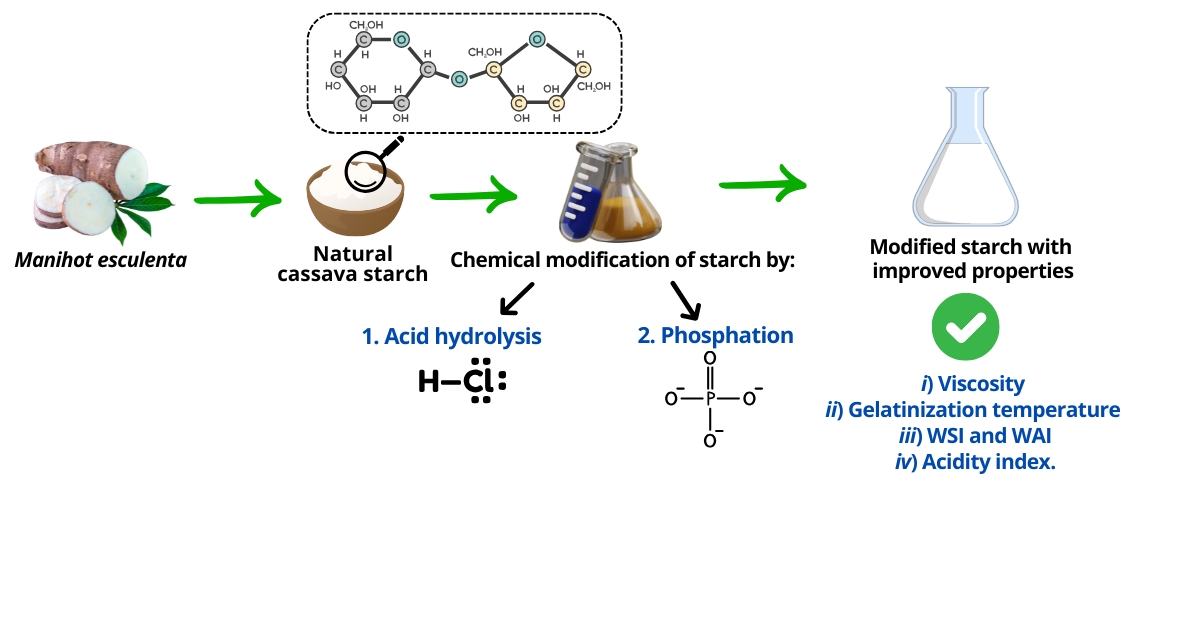
Optimization of Laboratory-scale Operating Conditions for the Modification of Cassava Starch (Manihot esculenta) Via Acid Hydrolysis and Phosphation
DOI:
https://doi.org/10.29356/jmcs.v70i1.2416Keywords:
Acid hydrolysis, Manihot esculenta, modified starch, phosphation, physicochemical propertiesAbstract
Abstract. This study explores the chemical modification of natural cassava starch through acid hydrolysis and phosphation, evaluating the impact of these treatments on key physicochemical properties such as viscosity, gelatinization temperature, water solubility, and acidity index. The reaction parameters for each process were optimized, including HCl concentration, sodium tripolyphosphate (TPS) concentration, and reaction time, achieving optimal conditions of 0.5 N HCl for 1 h for acid hydrolysis and 0.1 % TPS for 1 h for phosphation. These parameters were selected for their efficiency and cost-effectiveness in terms of reagent consumption and processing time, resulting in a significant improvement in the physicochemical properties of the starch. Acid hydrolysis reduced the viscosity of the starch, indicating a change in its molecular structure, while the gelatinization temperature increased, suggesting enhanced thermal stability. Water solubility showed a substantial increase, indicating greater availability for different applications. Phosphation with sodium tripolyphosphate also improved solubility and the acidity index due to the introduction of phosphate groups. Together, these results demonstrate that both treatments are highly effective in modifying cassava starch, expanding its potential for use in industries such as food, bioplastics, and pharmaceuticals, where the improved properties can offer new opportunities for the development of innovative products.
Resumen. Este estudio explora la modificación química del almidón de yuca natural mediante hidrólisis ácida y fosfatación, evaluando el impacto de estos tratamientos sobre sus propiedades fisicoquímicas clave, como la viscosidad, la temperatura de gelatinización, la solubilidad en agua y el índice de acidez. Se optimizaron los parámetros de reacción para cada proceso, incluyendo la concentración de HCl, la concentración de tripolifosfato de sodio (TPS) y el tiempo de tratamiento, alcanzando condiciones óptimas de 0.5 N de HCl durante 1 h para la hidrólisis ácida y 0.1 % de TPS durante 1 h para la fosfatación. Estos parámetros fueron seleccionados por su eficiencia y bajo costo en términos de consumo de reactivos y tiempo de procesamiento, lo que resultó en una mejora significativa de las propiedades fisicoquímicas del almidón. La hidrólisis ácida redujo la viscosidad del almidón, evidenciando una alteración en su estructura molecular, mientras que la temperatura de gelatinización aumentó, indicando una mayor estabilidad térmica. La solubilidad en agua mostró un incremento sustancial, lo que sugiere una mayor disponibilidad para diversas aplicaciones. Por su parte, la fosfatación con tripolifosfato de sodio también mejoró la solubilidad y el índice de acidez, debido a la introducción de grupos fosfato. En conjunto, estos resultados demuestran que ambos tratamientos son altamente efectivos para modificar el almidón de yuca, ampliando su potencial de uso en industrias como la alimentaria, la de bioplásticos y la farmacéutica, donde las propiedades mejoradas pueden ofrecer nuevas oportunidades para el desarrollo de productos innovadores.
Downloads
References
1. Bello-Perez, L. A.; Flores-Silva, P. C.; Agama-Acevedo, E.; Tovar, J. Sci. Food Agric. 2020, 100, 5009–5016. DOI: https://doi.org/10.1002/jsfa.8955
2. Hamaker, B. R. Curr. Opin. Food Sci. 2021, 40, 46–50. DOI: https://doi.org/10.1016/j.cofs.2021.01.003
3. Amaraweera, S. M.; Gunathilake, C.; Gunawardene, O. H. P.; Fernando, N. M. L.; Wanninayaka, D. B.; Dassanayake, R. S.; Rajapaksha, S. M.; Manamperi, A.; Fernando, C. A. N.; Kulatunga, A. K.; Manipura, A. Molecules. 2021, 26, 6880.DOI: https://doi.org/10.3390/molecules26226880
4. Homayouni, A.; Amini, A.; Keshtiban, A. K.; Mortazavian, A. M.; Esazadeh, K.; Pourmoradian, S. Starch – Stärke. 2014, 66, 102–114. DOI: https://doi.org/10.1002/star.201300110
5. Versino, F.; Lopez, O. V.; Garcia, M. A.; Zaritzky, N. E. Starch – Stärke. 2016, 68, 1026–1037. DOI: https://doi.org/10.1002/star.201600095
6. Ren, Y.; Yuan, T. Z.; Chigwedere, C. M.; Ai, Y. Compr. Rev. Food Sci. Food Saf. 2021, 20, 3061–3092. DOI: https://doi.org/10.1111/1541-4337.12735
7. Wang, Y.; Chen, L.; Yang, T.; Ma, Y.; McClements, D. J.; Ren, F.; Tian, Y.; Jin, Z. Food Hydrocoll. 2021, 113, 106543. DOI: https://doi.org/10.1016/j.foodhyd.2020.106543
8. Udoro, E. O.; Anyasi, T. A.; Jideani, A. I. O. Processes. 2021, 9, 1891. DOI: https://doi.org/10.3390/pr9111891
9. Adefegha, S. A.; Okeke, B. M.; Oyeleye, S. I.; Oboh, G. J. Food Process. Preserv. 2021, 45, e15586. DOI: https://doi.org/10.1111/jfpp.15586
10. Abotbina, W.; Sapuan, S. M.; Ilyas, R. A.; Sultan, M. T. H.; Alkbir, M. F. M.; Sulaiman, S.; Harussani, M. M.; Bayraktar, E. Materials. 2022, 15, 6992. DOI: https://doi.org/10.3390/ma15196992
11. Ghani, R. S. M.; Lee, M. D.; Razali, S. M. J. Emerg. Technol. Ind. Appl. 2023, 2.
12. Wang, X.; Huang, L.; Zhang, C.; Deng, Y.; Xie, P.; Liu, L.; Cheng, J. Carbohydr. Polym. 2020, 240, 116292. DOI: https://doi.org/10.1016/j.carbpol.2020.116292
13. Kaur, L.; Kaur, R.; Singh, J., in: Chapter 5 - Chemical Modification of Starch. In Starch in Food (Third Edition); Nilsson, L., Ed.; Woodhead Publishing, 2024, 97–117. DOI: https://doi.org/10.1016/B978-0-323-96102-8.00015-2
14. Zarski, A.; Kapusniak, K.; Ptak, S.; Rudlicka, M.; Coseri, S.; Kapusniak, J. Polymers. 2024, 16, 597. DOI: https://doi.org/10.3390/polym16050597
15. Wang, S.; Copeland, L. Crit. Rev. Food Sci. Nutr. 2015, 55, 1081-1097. DOI: https://doi.org/10.1080/10408398.2012.684551
16. Khlestkin, V. K.; Peltek, S. E.; Kolchanov, N. Carbohydr. Polym. 2018, 181, 460–476. DOI: https://doi.org/10.1016/j.carbpol.2017.10.035
17. Cruz-Benítez, M. M.; Gómez-Aldapa, C. A.; Castro-Rosas, J.; Hernández-Hernández, E.; Gómez-Hernández, E.; Fonseca-Florido, H. LWT 2019, 105, 110–117. DOI: https://doi.org/10.1016/j.lwt.2019.01.069
18. Gutiérrez, T. J.; Morales, N. J.; Pérez, E.; Tapia, M. S.; Famá, L. Food Packag. Shelf Life 2015, 3, 1–8. DOI: https://doi.org/10.1016/j.fpsl.2014.09.002
19. Vargas-León, E. A.; Falfan-Cortes, R. N.; Navarro-Cortez, R. O.; Hernández-Ávila, J.; Castro-Rosas, J.; Gómez-Aldapa, C. A. CyTA - J. Food. 2019, 17, 632–639. DOI: https://doi.org/10.1080/19476337.2019.1624623
20. Chiu, C.; Solarek, D., in: Chapter 17 - Modification of Starches. In Starch (Third Edition); BeMiller, J., Whistler, R., Eds.; Food Science and Technology; Academic Press: San Diego, 2009, 629–655. DOI: https://doi.org/10.1016/B978-0-12-746275-2.00017-3
21. Aristizábal Galvis, J.; Sanchez, T.; Lorío, D. Technical Guide for Analysis and Production of Cassava Starch. 2007.
22. Arrieta, P.; Pérez Sira, E. Preparación y Caracterización Fisico-Química y Reológica de Almidones de Yuca Modificados Químicamente Por Fosfatación, Acetilación y Doble Derivación. 1996.
23. Zhu, F. Carbohydr. Polym. 2015, 122, 456–480. DOI: https://doi.org/10.1016/j.carbpol.2014.10.063
24. Chisenga, S. M.; Workneh, T. S.; Bultosa, G.; Alimi, B. A. J. Food Sci. Technol. 2019, 56, 2799–2813. DOI: https://doi.org/10.1007/s13197-019-03814-6
25. Li, S.; Cui, Y.; Zhou, Y.; Luo, Z.; Liu, J.; Zhao, M. J. Sci. Food Agric. 2017, 97, 2282–2290. DOI: https://doi.org/10.1002/jsfa.8287
26. Salcedo, J.; Figueroa-Flórez, J. Agroindustria de Productos Amilaceos: Almidones Modificados. 2017.
27. Zeng, L.; Mao, W.; Hao, J.; Ye, G.; Song, X.; Zeng, L.; Wang, S.; Zhou, J. Ind. Crops Prod. 2022, 177, 114453. DOI: https://doi.org/10.1016/j.indcrop.2021.114453
28. Villa Zabala, C. C., in: An Overview on Starch Structure and Chemical Nature. In Starch-based Nanomaterials; Villa Zabala, C. C., Ed.; Springer International Publishing: Cham, 2020, 3–9. DOI: https://doi.org/10.1007/978-3-030-42542-5_2
29. Sumardiono, S.; Jos, B.; Pudjihastuti, I.; Sari, R. J.; Kumala, W. D. N.; Cahyono, H. J. Food Process. Preserv. 2022, 46, e16111. DOI: https://doi.org/10.1111/jfpp.16111
30. Palavecino, P. M.; Penci, M. C.; Ribotta, P. D. Food Bioprocess Technol. 2020, 13, 112–120. DOI: https://doi.org/10.1007/s11947-019-02381-0
31. Chakraborty, I.; N, P.; Mal, S. S.; Paul, U. C.; Rahman, Md. H.; Mazumder, N. Food Bioprocess Technol. 2022, 15, 1195–1223. DOI: https://doi.org/10.1007/s11947-022-02761-z
32. Singh Sandhu, K.; Singh, N.; Lim, S.-T. LWT - Food Sci. Technol. 2007, 40, 1527–1536. DOI: https://doi.org/10.1016/j.lwt.2006.12.012
33. Olorunsola, E. Niger. J. Pharm. Sci. 2011, 10, 73-80.
34. Amaraweera, S. M.; Gunathilake, C.; Gunawardene, O. H. P; Fernando, M. L. F.; Wanninayaka, D. B.; Manamperi, A.; Dassanayake, R. S.; Rajapaksha, S. M.; Gangoda, M.; Fernando, C. A. N.; Kulatunga, A. K.; Manipura, A. Cellulose. 2021, 28, 10531–10548. DOI: https://doi.org/10.1007/s10570-021-04199-6
35. Wang, Z.; Mhaske, P.; Farahnaky, A.; Kasapis, S.; Majzoobi, M. Food Hydrocoll. 2022, 129, 107542. Vhttps://doi.org/10.1016/j.foodhyd.2022.107542
36. Salata, C. da C.; Leonel, M.; Trombini, F. R. M.; Mischan, M. M. Food Sci. Technol. 2014, 34, 501–506. DOI: https://doi.org/10.1590/1678-457x.6337
37. Aidoo, R.; Oduro, I. N.; Agbenorhevi, J. K.; Ellis, W. O.; Pepra-Ameyaw, N. B. Int. J. Food Prop. 2022, 25, 561–569. DOI: https://doi.org/10.1080/10942912.2022.2052087
38. Królikowska, K.; Pietrzyk, S.; Pustkowiak, H.; Wolak, KJ. Food Sci. Technol. 2022, 59, 1440–1449. DOI: https://doi.org/10.1007/s13197-021-05153-x
39. Maniglia, B. C.; Castanha, N.; Le-Bail, P.; Le-Bail, A.; Augusto, P. E. D. Crit. Rev. Food Sci. Nutr. 2021, 61, 2482–2505. DOI: https://doi.org/10.1080/10408398.2020.1778633
40. Quintero Pimiento, C. R.; Fernández, P. V.; Ciancia, M.; López-Córdoba, A.; Goyanes, S.; Bertuzzi, M. A.; Foresti, M. L. Polymers. 2023, 15, 4263. DOI: https://doi.org/10.3390/polym15214263
41. Singh, R.; Kaur, S.; Sachdev, P. A. J. Food Meas. Charact. 2021, 15, 3168–3181. DOI: https://doi.org/10.1007/s11694-021-00887-w
42. Jia, B.; Devkota, L.; Sissons, M.; Dhital, S. Food Chem. 2023, 426, 136524. DOI: https://doi.org/10.1016/j.foodchem.2023.136524
43. Tan, S. X.; Ong, H. C.; Andriyana, A.; Lim, S.; Pang, Y. L.; Kusumo, F.; Ngoh, G. C. Polymers. 2022, 14, 278. DOI: https://doi.org/10.3390/polym14020278
44. Lemos, P. V. F.; Marcelino, H. R.; Cardoso, L. G.; Souza, C. O. de; Druzian, J. I. Int. J. Biol. Macromol. 2021, 184, 218–234. DOI: https://doi.org/10.1016/j.ijbiomac.2021.06.077
45. Gamal, A.; M. F. Elbaz, A. Food Technol. Res. J. 2024, 5, 110–122. DOI: https://doi.org/10.21608/ftrj.2024.382249
46. Tiruneh, A. T.; Negatu, A. A.; Satheesh, N. Int. J. Food Sci. 2021, 2021, 6615273. DOI: https://doi.org/10.1155/2021/6615273
47. Majzoobi, M.; Farahnaky, A. Food Hydrocoll. 2021, 111, 106393. DOI: https://doi.org/10.1016/j.foodhyd.2020.106393

Downloads
Published
Issue
Section
License
Copyright (c) 2025 Diana Fiallos, Vanessa Rosales, Kiara Montiel-Centeno , Danilo López-Valerio

This work is licensed under a Creative Commons Attribution-NonCommercial 4.0 International License.
Authors who publish with this journal agree to the following terms:
- Authors retain copyright and grant the journal right of first publication with the work simultaneously licensed under a Creative Commons Attribution License that allows others to share the work with an acknowledgement of the work's authorship and initial publication in this journal.
- Authors are able to enter into separate, additional contractual arrangements for the non-exclusive distribution of the journal's published version of the work (e.g., post it to an institutional repository or publish it in a book), with an acknowledgement of its initial publication in this journal.