Triazoles Nanoencapsulation in Polylactic Acid to Reduce Phytotoxicity in Roots
DOI:
https://doi.org/10.29356/jmcs.v69i3.2254Keywords:
Fungicide, fusarium, phytotoxicity, propiconazole, polylactideAbstract
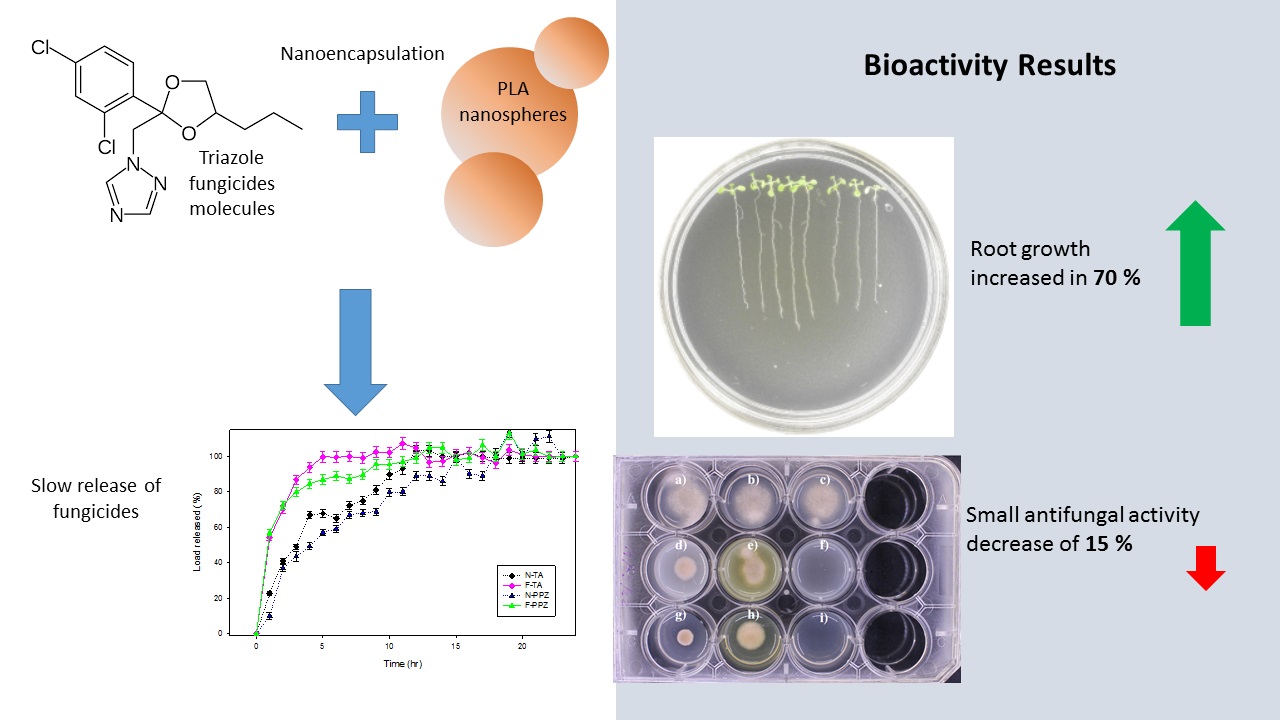
Abstract. The use of effective fungicides, such as propiconazole, a high-efficacy and broad-spectrum systemic fungicide, has been a common commercial strategy to combat fungal diseases. However, their indiscriminate and uncontrolled use provokes phytotoxicity in plant roots. Therefore, the objective of this study is to reduce the root phytotoxicity of triazole fungicides through their nanoencapsulation in biodegradable polylactic acid polymer matrices. Using the emulsion and solvent evaporation encapsulation method, the obtained nanoparticles had a hydrodynamic diameter of approximately 200 to 400 nm, an encapsulation efficiency of around 40 %, a smooth surface, and a zeta potential close to -40 mV, having great colloidal stability. Experiments with Arabidopsis thaliana demonstrated that the nanoencapsulation of a fungicide derived from propiconazole reduced its phytotoxicity, increasing the length of the roots over 70 % more than when the molecule was applied directly, losing only about 15 % of its antifungal activity, as shown by the test performed on Fusarium solani. This suggests that nanoencapsulation with biodegradable polymer matrices acts as a protective mechanism for plant roots, which may have practical applications in crop protection and the promotion of sustainable agriculture.
Resumen. El uso de fungicidas eficaces, como el propiconazol, un fungicida sistémico de alta eficacia y amplio espectro, ha sido una estrategia comercial común para combatir las enfermedades fúngicas. Sin embargo, su uso indiscriminado y descontrolado provoca fitotoxicidad en las raíces de las plantas. Por lo tanto, el objetivo de este estudio es reducir la fitotoxicidad radicular de fungicidas triazoles mediante su nanoencapsulación en matrices poliméricas de ácido poliláctico biodegradables. Utilizando el método de encapsulación por emulsión y evaporación de solvente, las nanopartículas obtenidas tuvieron un diámetro hidrodinámico de aproximadamente 200 a 400 nm, una eficiencia de encapsulación de alrededor del 40 %, una superficie lisa y un potencial zeta cercano a -40 mV, teniendo una gran estabilidad coloidal. Experimentos con Arabidopsis thaliana demostraron que la nanoencapsulación de un fungicida derivado del propiconazol redujo su fitotoxicidad, aumentando la longitud de las raíces un 70 % más que cuando la molécula se aplicó directamente, perdiendo sólo alrededor del 15 % de su actividad antifúngica, como lo demuestra la prueba realizada en Fusarium solani. Esto sugiere que la nanoencapsulación con matrices poliméricas biodegradables actúa como un mecanismo protector para las raíces de las plantas, lo que puede tener aplicaciones prácticas en la protección de cultivos y la promoción de la agricultura sostenible.
Downloads
References
Tyśkiewicz, R.; Nowak, R.; Ozimek, E.; Jaroszuk-Ściseł, J. Int. J. Mol. Sci. 2022, 23, Article 4. DOI: https://doi.org/10.3390/ijms23042329.
Savary, S.; Ficke, S.; Aubertot, J.N.; Hollier, C. Food Secur. 2012, 4, 519-537. DOI: https://doi.org/10.1007/s12571-012-0200-5.
Gura, W.; Gelain, J.; Sikora, E.; Vinson, E.L.; Brannen, P.; Schnabel, G. Plant Dis. 2023, Aug 14. DOI: https://doi.org/10.1094/PDIS-04-23-0778-RE.
Eatough Jones, M.; Kabashima, J.; Eskalen, A.; Mayorquin, J.; Carrillo, J.; Hanlon, C.; Paine, T. J. Econ. Entomol. 2017, 110, 1611-1618. DOI: https://doi.org/0.1093/jee/tox163. DOI: https://doi.org/10.1093/jee/tox163
Bonilla, I.; De La Cruz, O.L.; Sánchez, D.; Ortiz, R.; Rodríguez, B.; Barrera-Méndez, F.; Gómez, R.E.; Medrano, F.J.; Olivares, J.L. J. Mex. Chem. Soc. 2019, 62. DOI: https://doi.org/10.29356/jmcs.v62i3.531.
Bazzini, P.; Wermuth, C. Substituent Groups., in: The Practice of Medicinal Chemistry: Fourth Edition Georges, C.; Aldous, D.; Raboisson, P.; Rognan, D. Ed., Academic Press, London, 2008, 319-357. DOI: https://doi.org/10.1016/B978-0-12-417205-0.00013-4
Baker, S.; Volova, T.; Prudnikova, S.V.; Satish, S.; Prasad, M.N. Environ. Toxicol. Pharmacol. 2017, 53, 10-17. DOI: https://doi.org/10.1016/j.etap.2017.04.012.
Arora, S.; Murmu, G.; Mukherjee, K.; Saha, S.; Maity, D. J. Biotechnol. 2022, 355, 21-41. DOI: https://doi.org/10.1016/j.jbiotec.2022.06.007.
Lopez, K.S., in: Nanotransportadores de polifenoles: Aplicación en la industria cosmética [Polyphenol nanocarriers: application in the cosmetic industry]. Disertation, University of Cartagena, Colombia. 2023. DOI: https://doi.org/10.57799/11227/12239.
Shalini, K.; Kumar, N.; Drabu, S.; Sharma, P.K. Beilstein J. Org. Chem. 2011, 7, 668-677. DOI: https://doi.org/10.3762/bjoc.7.79.
Tan, D.; Yuan, P.; Annabi-Bergaya, F.; Dong, F.; Liu, D.; He, H. Appl. Clay Sci. 2015, 114, 190-196. DOI: https://doi.org/10.1016/j.clay.2015.05.024.
Abigail, E.A.; Samuel, M.; Chidambaram, R. J. Taiwan Inst. Chem. Eng. 2016, 16, 318-326. DOI: https://doi.org/10.1016/j.jtice.2016.03.024.
Viirlaid, E.; Riiberg, R.; Mäeorg, U. Agronomy Research. 2015, 13, 152–1159. DOI: https://doi.org/10.1016/j.jtice.2016.03.024.
Maruyama, C.R.; Guilger, M.; Pascoli, M.; Bileshy-José, N.; Abhilash, P.C.; Fraceto, L.F.; de Lima, R. Sci. Rep. 2016, 6, Article 1. DOI: https://doi.org/10.1038/srep19768. DOI: https://doi.org/10.1038/srep23854
Hwisa, N.; Katakam, P.; Rao, C.; Adiki, S. VRI Biol. Med. Chem. 2013, 1, 8-22. DOI: https://doi.org/10.14259/bmc.v1i1.29.
Barrera-Méndez, F.; Miranda, D.A.; Sánchez, D.; Bonilla, I.; Rodríguez, J.B.; Monribot, J.L.; Olivares, J.L. J. Mex. Chem. Soc. 2019, 63. DOI: https://doi.org/10.29356/jmcs.v63i1.564.
Öcal, H.; Arıca-Yegin, B.; Vural, İ.; Goracinova, K.; Çalış, S. Drug Dev. Ind. Pharm. 2014, 40, 560-567. DOI: https://doi.org/10.3109/03639045.2013.775581.
Ali, S.H.H.A.; Al-Qubaisi, M.; Hussein, M.Z.; Ismail, M.; Zainal, Z.; Hakim, M.N. Int. J. Nanomedicine. 2012, 7, 3351-3363. DOI: https://doi.org/10.2147/IJN.S30809.
Kuchovská, E.; Morin, B.; López-Cabeza, R.; Barré, M.; Gouffier, C.; Bláhová, L.; Cachot, J.; Bláha, L.; Gonzalez, P. Sci. Total Environ. 2021, 764, 142921. DOI: https://doi.org/10.1016/j.scitotenv.2020.142921.
Banpean, A.; Hararak, B.; Winotapun, C.; Wijaranakul, P.; Kitchaicharoenporn, S.; Naimlang, S. J. Mater. Sci. 2023, 58, 6823-6838. DOI: https://doi.org/10.1007/s10853-023-08418-2.
Xiao, R.Z.; Zeng, Z.W.; Zhou, G.L.; Wang, J.J.; Li, F.Z.; Wang, A.M. Int. J. Nanomedicine 2010, 5, 1057-1065. DOI: https://doi.org/10.2147/IJN.S14912.
Arpagaus, C. J. Pharm. Investig. 2019, 49, 405-426. DOI: https://doi.org/10.1007/s40005-019-00441-3.
Bohrey, S.; Chourasiya, V.; Pandey, A. Nano Converg. 2016, 3, 3. DOI: https://doi.org/10.1186/s40580-016-0061-2.
Hickey, J.W.; Santos, J.L.; Williford, J.M.; Mao, H.Q. J. Control. Release. 2015, 219, 536-547. DOI: https://doi.org/10.1016/j.jconrel.2015.10.006.
Wei, Q.; Wei, W.; Lai, B.; Wang, L.Y.; Wang, Y.X.; Su, Z.G.; Ma, G.H. Int. J. Pharm. 2008, 359, 294-297. DOI: https://doi.org/10.1016/j.ijpharm.2008.03.027.
Honary, S.; Zahir, F. Trop. J. Pharm. Res. 2013, 12, Article 2. DOI: https://doi.org/10.4314/tjpr.v12i2.19.
Zielińska, A.; Ferreira, N.R.; Feliczak-Guzik, A.; Nowak, I.; Souto, E.B. Pharm. Dev. Technol. 2020, 25, 832-844. DOI: https://doi.org/10.1080/10837450.2020.1744008.
Kamiya, H.; Gotoh, K.; Shimada, M.; Uchikoshi, T.; Otani, Y.; Fuji, M.; Matsusaka, S.; Matsuyama, T.; Tatami, J.; Higashitani, K., in: Nanoparticle Technology Handbook, Naito, M.; Yokoyama, T.; Hosokawa, K.; Nogi, K., Ed., Elsevier, London, UK, 2008, 113–176. DOI: https://doi.org/10.1016/B978-044453122-3.50006-4
Muzibur Rahman, M.; Mohamed Asiri, A., in: Advances in Colloid Science [Internet]. IntechOpen 2016. DOI: https://doi.org/10.5772/62716, accessed in November 2023
Yoshimi, A.; Miyazawa, K.; Abe, K. J. Fungi 2017, 3, Article 4. DOI: https://doi.org/10.3390/jof3040063.
Nakamura, H.; Watano, S. ONA Powder Part. J. 2018, 35, 49-65. DOI: https://doi.org/10.14356/kona.2018011.
Narayanan, V.H.; Kost, B.; Lewandowski, A.; Durai, R.D.; Wawrzyniak, P.; Biela, T.; Wingenfeld, R.; Sabeth, H.; Schwarzer, R.; Brzeziński, M. Adv. Powder Technol. 2023, 34, 104205. DOI: https://doi.org/10.1016/j.apt.2023.104205.
Mulia, K.; Geraldine, V.; Krisanti, E.A. AIP Conf. Proc. 2021, 2344, 040005. DOI: https://doi.org/10.1063/5.0047483.
Snapp, S.; Kirk, W.; Román-Avilés, B.; Kelly, J. Hort. Science 2003, 38, 187-191. DOI: https://doi.org/10.21273/HORTSCI.38.2.187.

Downloads
Published
Issue
Section
License
Copyright (c) 2025 Jahsive S. Quintero-Beltrán, Gabriela Sánchez-Viveros, Roberto G. Chiquito-Contreras, Greta H. Rosas-Saito, Randy Ortíz-Castro, Israel Bonilla-Landa, José L. Olivares-Romero, Felipe Barrera-Méndez

This work is licensed under a Creative Commons Attribution-NonCommercial 4.0 International License.
Authors who publish with this journal agree to the following terms:
- Authors retain copyright and grant the journal right of first publication with the work simultaneously licensed under a Creative Commons Attribution License that allows others to share the work with an acknowledgement of the work's authorship and initial publication in this journal.
- Authors are able to enter into separate, additional contractual arrangements for the non-exclusive distribution of the journal's published version of the work (e.g., post it to an institutional repository or publish it in a book), with an acknowledgement of its initial publication in this journal.