Effects of Eco-Agricultural Production of Phenolic Active Principles Synthesis in sect. Nepetoideae (Lamiaceae) Species
DOI:
https://doi.org/10.29356/jmcs.v69i4.2224Keywords:
Lamiaceae, ecological cultivation, phenolics, rosmarinic acid, HPLCAbstract
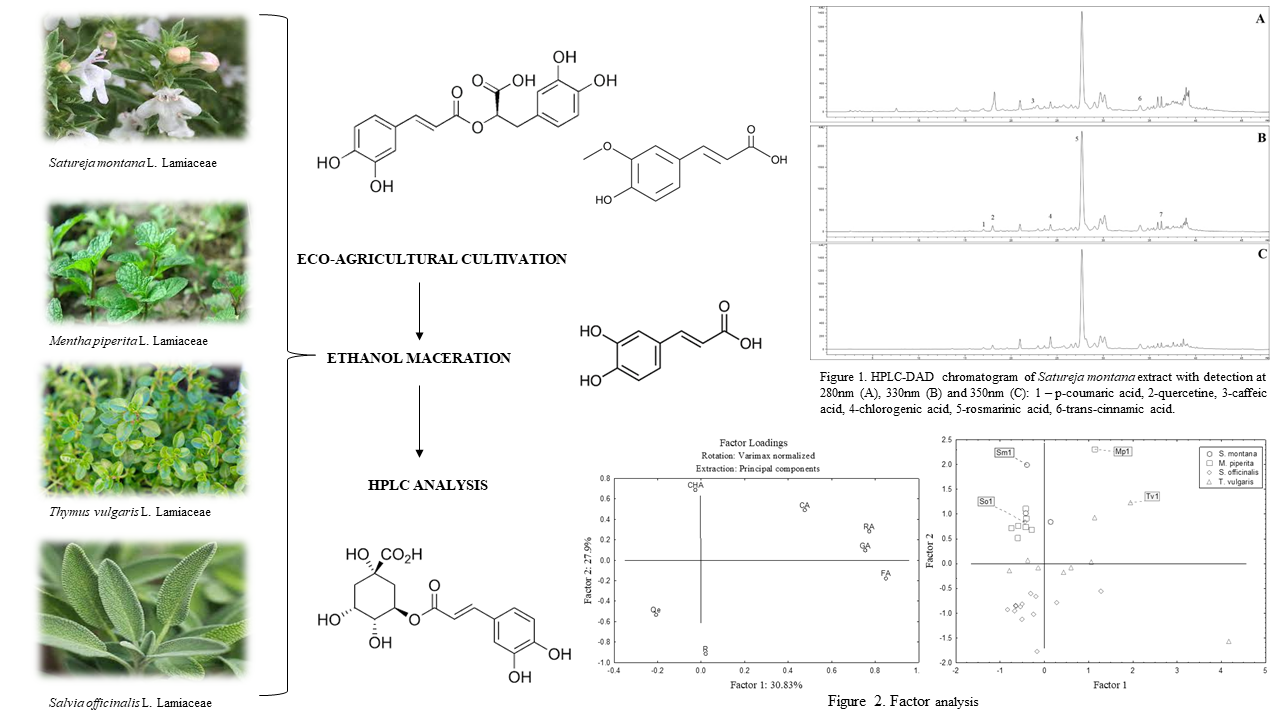
Abstract. One way of cultivating different aromatic Lamiaceae species, especially those classified in the Nepetoideae section, is eco-agricultural production. This modern trend makes new products with less environmental pollution and a high value for human health and nutrition. Winter savory (Satureja montana), peppermint (Mentha piperita), thyme (Thymus vulgaris), and sage (Salvia officinalis) are highly important medicinal plants that were introduced and are being successfully cultivated in agricultural fields in Vojvodina. This study aimed to determine 10 phenolic compounds in ethanolic extracts of peppermint, sage, thyme, and winter savory cultivated according to eco-agricultural principles. The amount of examined phenolic compounds was measured using liquid chromatography method (HPLC-DAD). In all four extracts, rosmarinic acid (RA) was the most abundant compound, with the highest amount recorded in peppermint (12863.6 µg/g), followed by thyme (7083.76 µg/g). Other detected compounds ranged from 29.29 to 484.37 µg/g for chlorogenic acid, 22.67 to 979.77 µg/g for caffeic acid, 11.8 to 339.59 µg/g for ferulic acid, not detected (ND) to 45.93 µg/g for p-coumaric acid, 14.9 to 63.72 µg/g for cinnamic acid, ND to 68.13 µg/g for gallic acid, LOD to 125.03 µg/g for rutin, 38.98 to 82.75 µg/g for quercetin. Quercitrin was detected only in sage (50.78 µg/g). The results suggest that peppermint especially accumulates higher amounts of RA when cultivated under ecological conditions. Therefore, it represents a valuable resource of biologically active compounds, and the whole process could contribute to sustainable development if post-distillation waste material is used.
Resumen. Una forma de cultivar diferentes especies aromáticas de Lamiaceae, especialmente aquellas clasificadas en la sección Nepetoideae, es la producción ecoagrícola. Esta nueva tendencia genera nuevos productos con menor contaminación ambiental y un alto valor para la salud y nutrición humana. La ajedrea (Satureja montana), la menta (Mentha piperita), el tomillo (Thymus vulgaris) y la salvia (Salvia officinalis) son plantas medicinales muy importantes que se introdujeron y se cultivan con éxito en los campos agrícolas de Vojvodina. Este estudio tuvo como objetivo determinar 10 compuestos fenólicos en extractos etanólicos de menta, salvia, tomillo y ajedrea cultivadas según principios ecoagrícolas. La cantidad de compuestos fenólicos examinados se midió utilizando el método de cromatografía líquida (HPLC-DAD). En los cuatro extractos, el ácido rosmarínico (AR) fue el compuesto más abundante, registrándose la mayor cantidad en la menta (12,863.6 µg/g), seguida del tomillo (7,083.76 µg/g). Otros compuestos detectados variaron de 29.29 a 484.37 µg/g para el ácido clorogénico, de 22.67 a 979.77 µg/g para el ácido cafeico, de 11.8 a 339.59 µg/g para el ácido ferúlico, de no detectado (ND) a 45.93 µg/g para el ácido p-cumárico, de 14.9 a 63.72 µg/g para el ácido cinámico, de ND a 68.13 µg/g para el ácido gálico, de LOD a 125.03 µg/g para la rutina, de 38.98 a 82.75 µg/g para la quercetina. La quercetina se detectó solo en salvia (50.78 µg/g). Los resultados sugieren que la menta, especialmente, acumula mayores cantidades de RA cuando se cultiva en condiciones ecológicas. Por lo tanto, representa una valiosa fuente de compuestos biológicamente activos y todo el proceso podría contribuir al desarrollo sostenible si se utilizan los residuos de la post-destilación.
Downloads
References
1. Bekut, M.; Brkić, S.; Kladar, N.; Dragović, G.; Gavarić, N.; Božin, B. Pharmacol. Res. 2018, 133. DOI: 10.1016/j.phrs.2017.12.016.
2. Zhao, F.; Chen, Y.P.; Salmaki, Y.; Drew, B.T.; Wilson, T.C.; Scheen, A.C.; Celep, F.; Bräuchler, C.; Bendiksby, M.; Wang, Q.; Min, D.Z.; Peng, H.; Olmstead, R.G.; Li, B.; Xiang, C.L. BMC Biol. 2021, 19, 2. DOI: 10.1186/s12915-020-00931-z.
3. Takhtadzhi︠a︡n, A. L.; Takhtajan, L. A.; Takhtajan, A., in: Diversity and classification of flowering plants. Columbia University Press: 1997.
4. Mimica-Dukic, N.; Bozin, B. Curr. Pharm. Des. 2008, 14, 3141-3150. DOI: 10.2174/138161208786404245.
5. Astutik, S.; Pretzsch, J.; Ndzifon Kimengsi, J. Sustainability. 2019, 11, 5483. DOI: 10.3390/su11195483.
6. Marcelino, S.; Hamdane, S.; Gaspar, P.D.; Paço, A. Sustainability. 2023, 15, 14095. DOI: 10.3390/su151914095.
7. Shang, Y.; Hasan, M.; Ahammed, G. J.; Li, M.; Yin, H.; Zhou, J. Molecules. 2019, 24, 2558. DOI: 10.3390/molecules24142558.
8. Möhring, N.; Finger, R. Food Policy. 2022, 106, 102188. DOI: ff10.1016/j.foodpol.2021.102188.
9. Shao, Y.; Chen, Z.; Xiao, H.; Zhu, Z.; Li, B. Environ. Sci. Eur. 2019, 31, 22. DOI: 10.1186/s12302-019-0204-2.
10. Golijan, J. Lekovite sirovine. 2016, 74-83. DOI: 10.5937/leksir1636074G.
11. Sikora, V.; Stojanović, A.; Popović, V.; Brdar-Jokanović, M.; Aćimović, M.; Kiprovski, B. Selekcija i semenarstvo. 2017, 23, 49-55. DOI: 10.5937/SelSem1701049S.
12. Jeremić, K.; Todorović, N.; Goločorbin-Kon, S.; Pavlović, N.; Milošević, N.; Gavarić, N.; Lalić-Popović, M. Timočki medicinski glasnik. 2019, 44, 56-62.
13. Raja, R. R. Res. J. Med. Plant 2012, 6, 203-213. DOI: 10.3923/rjmp.2012.203.213.
14. Hase, T.; Shishido, S.; Yamamoto, S.; Yamashita, R.; Nukima, H.; Taira, S.; Toyoda, T.; Abe, K.; Hamaguchi, T.; Ono, K. Sci. Rep. 2019, 9, 8711.
15. Fletcher, R. S.; Slimmon, T.; Kott, L. S. Open Agric. J. 2010, 4.
16. https://sweetgum.nybg.org/science/ih/herbarium-details/?irn=126775 accessed in January 2025.
17. Zlatković, B. K.; Bogosavljević, S. S.; Radivojević, A. R.; Pavlović, M. A. J. Ethnopharmacol. 2014, 151, 704-713. DOI: 10.1016/j.jep.2013.11.037.
18. World Health Organisation (WHO). WHO Traditional Medicinal Strategy: 2014-2023, 2013, https://iris.who.int/bitstream/handle/10665/92455/9789241506090_eng.pdf;jsessionid=90AB2063DEA42EADA317D933706EEFCD?sequence=1, accessed in August 2020.
19. Zhang, X.-L.; Guo, Y.-S.; Wang, C.-H.; Li, G.-Q.; Xu, J.-J.; Chung, H. Y.; Ye, W.-C.; Li, Y.-L.; Wang, G.-C. Food Chem. 2014, 152, 300-306. DOI: 10.1016/j.foodchem.2013.11.153.
20. Grygierczyk, G.; Sajewicz, M.; Staszek, D.; Wojtal, Ł.; Waksmundzka-Hajnos, M.; Kowalska, T. J. Liq. Chromatogr. Relat. Techn. 2009, 32, 1223-1240.
21. Roby, M. H. H.; Sarhan, M. A.; Selim, K. A.-H.; Khalel, K. I. Ind Crops Prod. 2013, 43, 827-831. DOI: 10.1016/j.indcrop.2012.08.029.
22. Shekarchi, M.; Hajimehdipoor, H.; Saeidnia, S.; Gohari, A. R.; Hamedani, M. P. Pharmacogn. Mag. 2012, 8, 37. DOI: 10.4103/0973-1296.93316.
23. Mišan, A.; Mimica-Dukić, N.; Mandić, A.; Sakač, M.; Milovanović, I.; Sedej, I. Open Chem. 2011, 9, 133-142. DOI: 10.2478/s11532-010-0126-8.
24. El Tawab, A. M. A.; Shahin, N. N.; AbdelMohsen, M. M. Chem. Biol. Interact. 2014, 224, 196-205. DOI: 10.1016/j.cbi.2014.11.001.
25. Kremer, D.; Kosir, I. J.; Koncic, M. Z.; Cerenak, A.; Potocnik, T.; Srecec, S.; Kosalec, I. Curr. Drug Targets 2015, 16, 1623-1633. DOI: 10.2174/1389450116666150202161926.
26. Ćetković, G. S.; Mandić, A. I.; Čanadanović‐Brunet, J. M.; Djilas, S. M.; Tumbas, V. T. J. Liq. Chromatogr. Rel. Technol. 2007, 30, 293-306. DOI: 10.1080/108260706010635.
27. Sofic, E.; Copra-Janicijevic, A.; Salihovic, M.; Tahirovic, I.; Kroyer, G. Med. Plants - Int. J. Phytomed. Relat. Ind. 2010, 2, 97-102. DOI: 10.5958/j.0975-4261.2.2.015.
28. Gavarić, N.; Kladar, N.; Mišan, A.; Nikolić, A.; Samojlik, I.; Mimica-Dukić, N.; Božin, B. Ind. Crops Prod. 2015, 74, 457-464. DOI: 10.1016/j.indcrop.2015.05.070.
29. Kozlowska, M.; Laudy, A. E.; Przybyl, J.; Ziarno, M.; Majewska, E. Acta Pol. Pharm. 2015, 72, 757-767.
30. Farnad, N.; Heidari, R.; Aslanipour, B. J. Food Meas. Charact. 2014, 8, 113-121. DOI: 10.1007/s11694-014-9171-x.
31. Moldovan, R.; Oprean, R.; Benedec, D.; Hanganu, D.; Duma, M.; Oniga, I.; Vlase, L. Dig. J. Nanomater. Biostruct. 2014, 9, 559-566.
32. Shan, B.; Cai, Y. Z.; Sun, M.; Corke, H. J. Agric. Food Chem. 2005, 53, 7749-7759. DOI: 10.1021/jf051513y.
33. Kozics, K.; Klusová, V.; Srančíková, A.; Mučaji, P.; Slameňová, D.; Hunáková, Ľ.; Kusznierewicz, B.; Horváthová, E. Food Chem. 2013, 141, 2198-2206. DOI: 10.1016/j.foodchem.2013.04.089.
34. Proestos, C.; Chorianopoulos, N.; Nychas, G.-J.; Komaitis, M. J. Agric. Food Chem. 2005, 53, 1190-1195. DOI: 10.1021/jf040083t.
35. Wojdyło, A.; Oszmiański, J.; Czemerys, R. Food Chem. 2007, 105, 940-949. DOI: 10.1016/j.foodchem.2007.04.038.
36. Zgórka, G.; Głowniak, K. J. Pharm. Biomed. Anal. 2001, 26, 79-87. DOI: 10.1016/S0731-7085(01)00354-5.
37. Milevskaya, V.; Temerdashev, Z.; Butyl’skaya, T.; Kiseleva, N. J. Anal. Chem. 2017, 72, 342-348. DOI: 10.1134/S1061934817030091.
38. Ben Farhat, M.; Jordán, M. a. J.; Chaouech-Hamada, R.; Landoulsi, A.; Sotomayor, J. A. J. Agric. Food Chem. 2009, 57, 10349-10356. DOI: 10.1021/jf901877x.
39. Farhat, M. B.; Landoulsi, A.; Chaouch-Hamada, R.; Sotomayor, J. A.; Jordán, M. J. Ind. Crops Prod. 2013, 49, 904-914. DOI: 10.1016/j.indcrop.2013.06.047.
40. Coisin, M.; Necula, R.; Grigoras, V.; Gille, E.; Rosenhech, E.; Zamfirache, M. M. Analele Stiintifice ale Universitatii" Al. I. Cuza" din Iasi. 2012, 58, 35.
41. Lima, C. F.; Valentao, P. C.; Andrade, P. B.; Seabra, R. M.; Fernandes-Ferreira, M.; Pereira-Wilson, C. Chem. Biol. Interact. 2007, 167, 107-115. DOI: 10.1016/j.cbi.2007.01.020.
42. Petersen, M.; Simmonds, M. S. Phytochemistry. 2003, 62, 121-125.
43. Lin, Y.-L.; Chang, Y.-Y.; Kuo, Y.-H.; Shiao, M.-S. J. Nat. Prod. 2002, 65, 745-747. DOI: 10.1021/np010538y.
44. Huang, S.-s.; Zheng, R.-l. Cancer Lett. 2006, 239, 271-280. DOI: 10.1016/j.canlet.2005.08.025.
45. Sanbongi, C.; Takano, H.; Osakabe, N.; Sasa, N.; Natsume, M.; Yanagisawa, R.; Inoue, K. i.; Sadakane, K.; Ichinose, T.; Yoshikawa, T. Clin. Exp. Allergy 2004, 34, 971-977. DOI: 10.1111/j.1365-2222.2004.01979.x.
46. Lee, J.; Kim, Y. S.; Park, D. Biochem. Pharmacol. 2007, 74, 960-968. DOI: 10.1016/j.bcp.2007.06.007.
47. Osakabe, N.; Yasuda, A.; Natsume, M.; Yoshikawa, T. Carcinogenesis 2004, 25, 549-557. DOI: 10.1093/carcin/bgh034.
48. Lin, Y.; Shi, R.; Wang, X.; Shen, H.-M. Curr. Cancer Drug Targets 2008, 8, 634-646. DOI: 10.2174/156800908786241050.
49. Psotova, J.; Svobodova, A.; Kolarova, H.; Walterova, D. J. Photochem. Photobiol. B: Biol. 2006, 84, 167-174. DOI: 10.1016/j.jphotobiol.2006.02.012.
50. Naveed, M.; Hejazi, V.; Abbas, M.; Kamboh, A. A.; Khan, G. J.; Shumzaid, M.; Ahmad, F.; Babazadeh, D.; FangFang, X.; Modarresi-Ghazani, F. Biomed. Pharmacother. 2018, 97, 67-74. DOI: 10.1016/j.biopha.2017.10.064.
51. Mancuso, C.; Santangelo, R. Food Chem. Toxicol. 2014, 65, 185-195. DOI: 10.1016/j.fct.2013.12.024.

Downloads
Published
Issue
Section
License
Copyright (c) 2025 Katarina Radovanović, Biljana Božin, Nebojša Kladar, Milica Aćimović, Maja Hitl, Neda Gavarić

This work is licensed under a Creative Commons Attribution-NonCommercial 4.0 International License.
Authors who publish with this journal agree to the following terms:
- Authors retain copyright and grant the journal right of first publication with the work simultaneously licensed under a Creative Commons Attribution License that allows others to share the work with an acknowledgement of the work's authorship and initial publication in this journal.
- Authors are able to enter into separate, additional contractual arrangements for the non-exclusive distribution of the journal's published version of the work (e.g., post it to an institutional repository or publish it in a book), with an acknowledgement of its initial publication in this journal.









